Actieve ingrediënten: agomelatine
Valdoxan 25 mg filmomhulde tabletten
Waarom wordt Valdoxan gebruikt? Waar is het voor?
Valdoxan bevat de werkzame stof agomelatine. Het behoort tot een groep geneesmiddelen die antidepressiva worden genoemd en Valdoxan is aan u voorgeschreven om depressie te behandelen.
Valdoxan wordt gebruikt bij volwassenen
Depressie is een aanhoudende stemmingsstoornis die het dagelijks leven verstoort Symptomen van depressie variëren van persoon tot persoon, maar omvatten vaak diepe droefheid, gevoelens van zelfspot, verlies van interesse in favoriete bezigheden, slaapstoornissen, een gevoel van vertraging, zich angstig voelen, gewichtsveranderingen.
De verwachte voordelen van Valdoxan zijn de geleidelijke vermindering en eliminatie van symptomen die verband houden met uw depressie.
Contra-indicaties Wanneer Valdoxan niet mag worden gebruikt
Neem Valdoxan niet in
- als u allergisch (overgevoelig) bent voor agomelatine of voor één van de andere bestanddelen van dit geneesmiddel (vermeld in rubriek 6),
- als de lever niet goed werkt (leverfunctiestoornis),
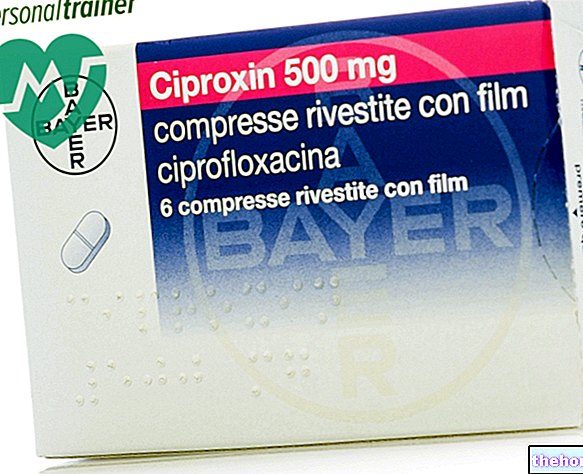
- als u fluvoxamine (een ander geneesmiddel tegen depressie) of ciprofloxacine (een antibioticum) gebruikt.
Voorzorgen bij gebruik Wat u moet weten voordat u Valdoxan inneemt
Het kan zijn dat Valdoxan om de een of andere reden niet geschikt voor u is
- Als u geneesmiddelen gebruikt die de leverfunctie beïnvloeden. Vraag uw arts om advies over welke medicijnen dit zijn.
- Als u zwaarlijvig of overgewicht heeft, vraag dan uw arts om advies.
- Als u diabetes heeft, vraag dan uw arts om advies.
- Als u vóór de behandeling verhoogde leverenzymwaarden heeft, zal uw arts beslissen of Valdoxan geschikt voor u is.
- Als u een bipolaire stoornis heeft, manische symptomen heeft gehad of ontwikkelt (een periode van abnormaal intense opwinding en emoties), neem dan contact op met uw arts voordat u begint met het innemen van het geneesmiddel of voordat u doorgaat met het innemen van het geneesmiddel (zie ook "Mogelijke bijwerkingen" in rubriek 4) .
- Als u aan dementie lijdt, zal uw arts een subjectieve beoordeling maken om te bepalen of het gebruik van Valdoxan veilig voor u is.
Tijdens de behandeling met Valdoxan:
Wat te doen om mogelijke ernstige leverproblemen te voorkomen:
- Uw arts moet ervoor zorgen dat uw lever goed werkt voordat u met de behandeling begint. Sommige patiënten kunnen tijdens de behandeling met Valdoxan verhoogde niveaus van leverenzymen in hun bloed hebben. Daarom moet een constante bewaking worden uitgevoerd volgens het volgende schema:
Op basis van de evaluatie van deze tests zal uw arts beslissen of u Valdoxan kunt gebruiken of kunt blijven gebruiken (zie ook "Hoe wordt Valdoxan ingenomen" in rubriek 3).
Let op tekenen en symptomen die erop kunnen wijzen dat uw lever niet goed werkt.
- Als u een van deze tekenen en symptomen van leverproblemen bemerkt: abnormale donkere verkleuring van de urine, lichtgekleurde ontlasting, gele verkleuring van de huid/ogen, pijn in de rechterbovenbuik, ongewone vermoeidheid (vooral geassocieerd met de andere symptomen hierboven vermeld), contact dringend een arts die u kan adviseren de behandeling met Valdoxan te stoppen.
Het effect van Valdoxan is niet gedocumenteerd bij patiënten van 75 jaar of ouder, daarom dient Valdoxan niet te worden gebruikt bij deze patiënten.
Gedachten aan zelfmoord en verergering van depressie
Als u depressief bent, kunt u soms gedachten hebben over zelfbeschadiging of zelfmoord. Deze gedachten kunnen verergeren wanneer u voor het eerst begint met de behandeling met antidepressiva, omdat het even duurt voordat deze geneesmiddelen werkzaam zijn, meestal ongeveer twee weken, maar soms zelfs langer.
Het is waarschijnlijker dat je zo denkt:
- als u eerder gedachten heeft gehad over zelfmoord of zelfbeschadiging,
- als u een jongvolwassene bent. Gegevens uit klinische onderzoeken hebben een verhoogd risico op suïcidaal gedrag aangetoond bij jonge volwassenen (jonger dan 25 jaar) met psychiatrische stoornissen die zijn behandeld met een antidepressivum.
Wanneer u gedachten heeft over zelfbeschadiging of zelfmoord, neem dan onmiddellijk contact op met uw arts of ga naar een ziekenhuis.
Misschien vindt u het nuttig om een familielid of goede vriend te vertellen dat u depressief bent en hen te vragen deze bijsluiter te lezen. U kunt hen vragen u te vertellen of ze denken dat uw depressie erger wordt of dat ze zich zorgen maken over veranderingen in uw gedrag.
Kinderen en adolescenten
Valdoxan is niet bedoeld voor gebruik bij kinderen en adolescenten (jonger dan 18 jaar).
Interacties Welke medicijnen of voedingsmiddelen kunnen het effect van Valdoxan . veranderen?
Vertel uw arts of apotheker als u andere geneesmiddelen gebruikt of kort geleden heeft gebruikt. Dit geldt ook voor geneesmiddelen die u zonder voorschrift kunt krijgen.
U mag Valdoxan niet samen met bepaalde geneesmiddelen gebruiken (zie ook "Wanneer mag u Valdoxan niet gebruiken" in rubriek 2): fluvoxamine (een ander geneesmiddel voor de behandeling van depressie) ciprofloxacine (een antibioticum) kan de verwachte dosis agomelatine in het bloed veranderen
Vertel het uw arts als u een van de volgende geneesmiddelen gebruikt: propranolol (een bètablokker die wordt gebruikt om hoge bloeddruk te behandelen), enoxacine (een antibioticum) en als u meer dan 15 sigaretten per dag rookt.
Waarop moet u letten met alcohol
Het wordt niet aanbevolen om alcohol te drinken tijdens de behandeling met Valdoxan.
Waarschuwingen Het is belangrijk om te weten dat:
Zwangerschap
Als u zwanger bent of borstvoeding geeft, denkt zwanger te zijn of zwanger wilt worden, vraag dan uw arts of apotheker om advies voordat u dit geneesmiddel inneemt.
Voedertijd
Vertel het uw arts als u borstvoeding geeft of van plan bent borstvoeding te geven, aangezien borstvoeding moet worden gestopt als u Valdoxan gebruikt.
vraag uw arts of apotheker om advies voordat u een geneesmiddel inneemt.
Rijvaardigheid en het gebruik van machines
U kunt zich duizelig of slaperig voelen, wat uw rijvaardigheid of uw vermogen om machines te bedienen kan beïnvloeden. Zorg ervoor dat uw reacties normaal zijn voordat u gaat autorijden of machines gaat gebruiken.
Valdoxan bevat lactose.
Als uw arts u heeft verteld dat u bepaalde suikers niet verdraagt, neem dan contact met hem op voordat u Valdoxan inneemt.
Dosis, wijze en tijdstip van toediening Hoe wordt Valdoxan gebruikt: Dosering
Gebruik dit geneesmiddel altijd precies zoals uw arts of apotheker u dat heeft verteld. Raadpleeg bij twijfel uw arts of apotheker.
De aanbevolen dosis Valdoxan is één tablet (25 mg) voor het slapengaan. In sommige gevallen kan uw arts een hogere dosis (50 mg) voorschrijven, namelijk twee tabletten die samen voor het slapengaan moeten worden ingenomen.
Bij de meeste depressieve mensen begint Valdoxan binnen twee weken na aanvang van de behandeling in te werken op de symptomen van depressie.Uw arts kan Valdoxan blijven voorschrijven als u zich beter voelt om te voorkomen dat de depressie terugkeert.De depressie moet gedurende een bepaalde periode worden behandeld. genoeg van ten minste 6 maanden om ervoor te zorgen dat u van de symptomen afkomt.
Stop niet met het innemen van het geneesmiddel zonder het advies van uw arts, ook niet als u zich beter voelt.
Valdoxan is voor oraal gebruik. U dient de tablet door te slikken met een slok water.Valdoxan kan met of zonder voedsel worden ingenomen.
Hoe overstappen van een antidepressivum (SSRI/SNRI) naar Valdoxan?
Als uw arts uw eerdere behandeling met antidepressiva verandert in een SSRI of SNRI en u Valdoxan voorschrijft, zal hij u adviseren hoe u uw vorige behandeling kunt stoppen wanneer u met de behandeling met Valdoxan begint.
Zelfs als de dosis van het vorige antidepressivum geleidelijk wordt verlaagd, kunt u ontwenningsverschijnselen krijgen die verband houden met het stoppen van het vorige geneesmiddel gedurende enkele weken Ontwenningsverschijnselen zijn onder meer: duizeligheid, gevoelloosheid, slaapstoornissen, opwinding of angst, hoofdpijn, misselijkheid, malaise en tremor Deze effecten zijn gewoonlijk licht tot matig van aard en verdwijnen spontaan binnen enkele dagen.
Als u Valdoxan begint te gebruiken terwijl u de dosering van het vorige geneesmiddel verlaagt, mogen de mogelijke ontwenningsverschijnselen niet worden verward met het ontbreken van de vroege voordelen van Valdoxan.
Wanneer u met Valdoxan begint, dient u met uw arts te bespreken wat de beste manier is om uw eerdere behandeling met antidepressiva te stoppen.
Surveillance van de leverfunctie (zie ook rubriek 2):
Uw arts kan laboratoriumtests bestellen om te controleren of uw lever goed werkt voordat u met de behandeling begint en daarna periodiek tijdens de behandeling, gewoonlijk na 3 weken, 6 weken, 12 weken en 24 weken.Als uw arts de dosis die u inneemt verhoogt tot 50 mg, moeten laboratoriumtests worden uitgevoerd bij het starten van de nieuwe dosering en daarna periodiek tijdens de behandeling, gewoonlijk na 3 weken, 6 weken, 12 weken en 24 weken. uw arts acht dit noodzakelijk. Als uw lever niet goed werkt, mag u Valdoxan niet gebruiken.
Als u nierproblemen heeft, zal uw arts een individuele beoordeling uitvoeren om te bepalen of het gebruik van Valdoxan veilig voor u is.
Overdosering Wat moet u doen als u te veel Valdoxan heeft ingenomen?
Wat u moet doen als u meer van Valdoxan heeft ingenomen dan u zou mogen
Als u meer Valdoxan heeft ingenomen dan is voorgeschreven, of als bijvoorbeeld een kind het geneesmiddel per ongeluk heeft ingenomen, neem dan onmiddellijk contact op met uw arts.
Ervaring met overdosering met Valdoxan is beperkt, maar de gemelde symptomen zijn pijn in de bovenbuik, slaperigheid, vermoeidheid, opwinding, angst, spanning, duizeligheid, cyanose of malaise.
Wat u moet doen wanneer u bent vergeten Valdoxan in te nemen
Neem geen dubbele dosis om een vergeten dosis in te halen. Neem uw volgende dosis op het gebruikelijke tijdstip.
De kalender die op de blisterverpakking met de tabletten is gedrukt, zal u helpen herinneren wanneer u uw laatste Valdoxan-tablet heeft ingenomen.
Als u stopt met het innemen van Valdoxan
Raadpleeg uw arts voordat u stopt met het gebruik van dit geneesmiddel.Als u denkt dat het effect van Valdoxan te sterk of te zwak is, neem dan contact op met uw arts of apotheker.
Als u nog vragen heeft over het gebruik van dit geneesmiddel, neem dan contact op met uw arts of apotheker.
Bijwerkingen Wat zijn de bijwerkingen van Valdoxan
Zoals alle geneesmiddelen kan ook dit geneesmiddel bijwerkingen hebben, al krijgt niet iedereen daarmee te maken.
De meeste bijwerkingen zijn licht of matig. Ze treden meestal op binnen de eerste twee weken van de behandeling en zijn meestal van voorbijgaande aard.
Bijwerkingen zijn onder meer:
- Vaak voorkomende bijwerkingen (komen voor bij minder dan 1 op de 10 gebruikers): duizeligheid, slaperigheid, slaapproblemen (slapeloosheid), migraine, hoofdpijn, misselijkheid (nausea), diarree, constipatie, buikpijn, overmatig zweten (hyperhidrose), rugpijn, vermoeidheid, angst, verhoogde niveaus van leverenzymen in het bloed, braken.
- Soms voorkomende bijwerkingen (komen voor bij minder dan 1 op de 100 gebruikers): tintelingen in de vingers en tenen (paresthesie), wazig zien, rustelozebenensyndroom (een aandoening die wordt gekenmerkt door een ongecontroleerde behoefte om de benen te bewegen), oorsuizen, eczeem , jeuk, netelroos, opwinding, prikkelbaarheid, rusteloosheid, agressief gedrag, nachtmerries, abnormale dromen, verwardheid.
- Zelden voorkomende bijwerkingen (komen voor bij minder dan 1 op de 1.000 gebruikers): ernstige huiduitslag (erythemateuze uitslag), gezichtsoedeem (zwelling) en angio-oedeem (zwelling van het gezicht, de lippen, tong en/of keel die ademhalingsmoeilijkheden kan veroorzaken bij het slikken) hepatitis, geel worden van de huid of het wit van de ogen (geelzucht), leverfalen*, manie/hypomanie (zie ook "Waarschuwingen en voorzorgen" in rubriek 2), hallucinaties, gewichtstoename, gewichtsafname in het lichaam.
- Andere mogelijke bijwerkingen:
Frequentie niet bekend (frequentie kan met de beschikbare gegevens niet worden bepaald): zelfmoordgedachten of zelfmoordgedrag.
* Sommige gevallen met levertransplantatie of fatale afloop zijn gemeld
Melding van bijwerkingen
Krijgt u last van bijwerkingen, neem dan contact op met uw arts of apotheker.Dit geldt ook voor mogelijke bijwerkingen die niet in deze bijsluiter staan. U kunt bijwerkingen ook rechtstreeks melden via het nationale meldsysteem zoals vermeld in aanhangsel V. Door bijwerkingen te melden, kunt u ons helpen meer informatie te verkrijgen over de veiligheid van dit geneesmiddel.
Vervaldatum en retentie
Buiten het zicht en bereik van kinderen houden.
Gebruik dit geneesmiddel niet meer na de uiterste houdbaarheidsdatum. Die is te vinden op de doos en de blisterverpakking. De uiterste houdbaarheidsdatum verwijst naar de laatste dag van de maand.
Voor dit geneesmiddel zijn er geen speciale bewaarcondities
Gooi geneesmiddelen niet weg via het afvalwater of met huishoudelijk afval. Vraag uw apotheker wat u met geneesmiddelen moet doen die u niet meer gebruikt. Dit helpt het milieu te beschermen.
Welke stoffen zitten er in Valdoxan?
- Het werkzame bestanddeel is agomelatine. Elke filmomhulde tablet bevat 25 mg agomelatine.
- De overige ingrediënten zijn:
- lactosemonohydraat, maïszetmeel, povidon, natriumzetmeelglycolaat type A, stearinezuur, magnesiumstearaat, watervrij colloïdaal siliciumdioxide, hypromellose, glycerol, macrogol, geel ijzeroxide (E172) en titaniumdioxide (E171).
- drukinkt: schellak, propyleenglycol en indigokarmijn aluminiumlak (E132).
Hoe ziet Valdoxan eruit en hoeveel zit er in een verpakking?
Valdoxan 25 mg filmomhulde tabletten zijn langwerpig, geeloranje, met het bedrijfslogo in blauw in reliëf aan één kant.
Valdoxan 25 mg tabletten zijn verkrijgbaar in kalenderblisterverpakkingen. De verpakkingen bevatten 7, 14, 28, 42, 56, 84 of 98 tabletten. Er zijn ook verpakkingen van 100 filmomhulde tabletten voor gebruik in het ziekenhuis verkrijgbaar
Mogelijk worden niet alle verpakkingsgrootten in de handel gebracht.
Bron Bijsluiter: AIFA (Italiaans Geneesmiddelenbureau). Inhoud gepubliceerd in januari 2016. De aanwezige informatie is mogelijk niet up-to-date.
Om toegang te hebben tot de meest actuele versie, is het raadzaam om de website van AIFA (Italian Medicines Agency) te bezoeken. Disclaimer en nuttige informatie.
01.0 NAAM VAN HET GENEESMIDDEL
VALDOXAN 25 MG TABLETTEN OMHOOG MET FILM
02.0 KWALITATIEVE EN KWANTITATIEVE SAMENSTELLING
Elke filmomhulde tablet bevat 25 mg agomelatine.
Hulpstof met bekende effecten: elke tablet bevat 61,84 mg lactose (als monohydraat).
Voor de volledige lijst van hulpstoffen, zie rubriek 6.1.
03.0 FARMACEUTISCHE VORM
Filmomhulde tablet [tablet].
Oranjegele, langwerpige, 9,5 mm lange, 5,1 mm brede filmomhulde tablet met het bedrijfslogo in blauw in reliëf aan één zijde.
04.0 KLINISCHE INFORMATIE
04.1 Therapeutische indicaties
Behandeling van depressieve episodes.
Valdoxan is geïndiceerd bij volwassenen.
04.2 Dosering en wijze van toediening
Dosering
De aanbevolen dosis is 25 mg eenmaal daags oraal in te nemen voor het slapengaan.
Als er na twee weken behandeling geen verbetering van de symptomen is opgetreden, kan de dosis worden verhoogd tot eenmaal daags 50 mg, dwz twee tabletten van 25 mg in een enkele inname, 's avonds voor het slapengaan.
De beslissing om de dosis te verhogen moet worden afgewogen in het licht van een hoger risico op transaminaseverhogingen. Elke dosisverhoging tot 50 mg dient te gebeuren op basis van de baten/risicoverhouding van de individuele patiënt, na een strikte controle van leverfunctietesten (LFT).
Bij alle patiënten dienen leverfunctietesten te worden uitgevoerd voordat met de behandeling wordt begonnen. De behandeling mag niet worden gestart als de transaminasen 3 keer de bovengrens van de normaalwaarde overschrijden (zie rubrieken 4.3 en 4.4).
Tijdens de behandeling dienen transaminasen periodiek te worden gecontroleerd na ongeveer drie weken, zes weken (einde van de acute fase), twaalf en vierentwintig weken (einde van de onderhoudsfase) en daarna indien klinisch geïndiceerd (zie ook rubriek 4.4). De behandeling moet worden gestaakt als de transaminasen 3 keer de bovengrens van de normaalwaarde overschrijden (zie rubrieken 4.3 en 4.4).
Wanneer de dosering wordt verhoogd, moeten opnieuw leverfunctietesten worden uitgevoerd met dezelfde frequentie als bij het begin van de behandeling.
Duur van de behandeling
Depressieve patiënten moeten gedurende een voldoende periode van ten minste 6 maanden worden behandeld om ervoor te zorgen dat ze geen symptomen meer hebben.
Verandering van therapie van een SSRI/SNRI-antidepressivum naar agomelatine
Patiënten kunnen ontwenningsverschijnselen krijgen na het stoppen met een SSRI/SNRI-antidepressivum.
Voor hoe de behandeling moet worden gestaakt om ontwenningsverschijnselen te voorkomen, dient de Samenvatting van de Productkenmerken van de SSRI/SNRI waarmee de patiënt wordt behandeld te worden geraadpleegd. Agomelatine kan onmiddellijk worden gestart terwijl de SSRI/SNRI-dosering wordt verlaagd (zie rubriek 5.1).
Stopzetting van de behandeling
In geval van onderbreking van de behandeling is een geleidelijke dosisverlaging niet nodig.
Speciale populaties
Oudere patiënten
De werkzaamheid en veiligheid van agomelatine (dosis 25 tot 50 mg/dag) zijn aangetoond bij oudere depressieve patiënten (dosisaanpassing leeftijd voor leeftijd (zie rubriek 5.2).
Patiënten met nierinsufficiëntie
Er werden geen relevante veranderingen in de farmacokinetische parameters van agomelatine waargenomen bij patiënten met een ernstige nierfunctiestoornis. Er zijn echter slechts beperkte klinische gegevens beschikbaar over het gebruik van Valdoxan bij depressieve patiënten met ernstige of matige nierinsufficiëntie met ernstige depressieve episodes.Daarom moet Valdoxan met voorzichtigheid worden voorgeschreven aan deze patiënten.
Patiënten met leverinsufficiëntie
Valdoxan is gecontra-indiceerd bij patiënten met een leverfunctiestoornis (zie rubrieken 4.3, 4.4 en 5.2).
Pediatrische populatie
De veiligheid en werkzaamheid van Valdoxan bij kinderen van 2 jaar en ouder voor de behandeling van depressieve episodes zijn nog niet vastgesteld.
Er zijn geen gegevens beschikbaar (zie rubriek 4.4).
Er is geen indicatie voor specifiek gebruik van Valdoxan vanaf de geboorte tot 2 jaar voor de behandeling van depressieve episodes.
Wijze van toediening
Voor oraal gebruik.
Valdoxan filmomhulde tabletten kunnen met of zonder voedsel worden ingenomen.
04.3 Contra-indicaties
Overgevoeligheid voor de werkzame stof of voor één van de in rubriek 6.1 vermelde hulpstoffen.
Leverfunctiestoornis (bijv. huidige cirrose of leverziekte) (zie rubrieken 4.2 en 4.4) of transaminasen die 3 maal de bovengrens van normaal overschrijden (zie rubrieken 4.2 en 4.4).
Gelijktijdig gebruik van krachtige CYP1A2-remmers (bijv. fluvoxamine, ciprofloxacine) (zie rubriek 4.5).
04.4 Bijzondere waarschuwingen en passende voorzorgen bij gebruik
Monitoring van de leverfunctie
Gevallen van leverbeschadiging, waaronder leverinsufficiëntie (sommige gevallen met fatale afloop of levertransplantatie bij patiënten met risicofactoren voor de lever zijn uitzonderlijk gemeld bij patiënten met risicofactoren voor de lever) en enzymverhogingen zijn gemeld bij patiënten die werden behandeld met een 10 keer zo hoge Valdoxan-leverziekte. bovengrens van normaal, hepatitis en geelzucht (zie rubriek 4.8) De meeste hiervan traden op tijdens de eerste maanden van de behandeling Het type leverbeschadiging is in wezen hepatocellulair met serumtransaminasen die gewoonlijk terugkeren naar normale waarden na stopzetting van Valdoxan.
Voorzichtigheid is geboden voordat met de behandeling wordt begonnen en er dient nauwlettend toezicht te worden gehouden tijdens de gehele behandelingsperiode bij alle patiënten, vooral als er risicofactoren voor leverbeschadiging aanwezig zijn of als gelijktijdig geneesmiddelen worden toegediend die in verband worden gebracht met het risico op leverbeschadiging.
• Voor aanvang van de behandeling
Valdoxan mag alleen worden voorgeschreven aan patiënten met risicofactoren voor leverbeschadiging, zoals obesitas/overgewicht/niet-alcoholische leververvetting, diabetes, zwaar alcoholgebruik en bij patiënten die gelijktijdig geneesmiddelen krijgen die in verband worden gebracht met het risico op leverbeschadiging. evaluatie van de voordelen en risico's.
Leverfunctietests op baseline dienen bij alle patiënten te worden uitgevoerd en de behandeling mag niet worden gestart bij patiënten met een baseline ALT en/of ASAT > 3 maal de ULN (zie rubriek 4.3).
Voorzichtigheid is geboden wanneer Valdoxan wordt toegediend aan patiënten met verhoogde transaminasen voorafgaand aan de behandeling (> de bovengrens van het normale bereik en ≤ 3 keer de bovengrens van het normale bereik).
• Frequentie van leverfunctietesten
- Voor aanvang van de behandeling
- dan:
- na ongeveer 3 weken
- na ongeveer 6 weken (einde acute fase)
- na ongeveer 12 en 24 weken (einde van de onderhoudsfase)
- en daarna indien klinisch geïndiceerd.
Wanneer de dosering wordt verhoogd, moeten opnieuw leverfunctietesten worden uitgevoerd met dezelfde frequentie als bij het begin van de behandeling.
Patiënten die verhoogde serumtransaminasen ontwikkelen, moeten de leverfunctietests binnen 48 uur herhalen.
• Tijdens de behandelperiode
De behandeling met Valdoxan moet onmiddellijk worden stopgezet als:
- de patiënt symptomen of tekenen van mogelijke leverbeschadiging ontwikkelt (zoals donkere urine, lichtgekleurde ontlasting, gele verkleuring van de huid/ogen, pijn in de rechterbovenbuik, een gevoel van langdurige en onverklaarbare nieuwe vermoeidheid.
- de toename van serumtransaminasen is 3 keer groter dan de bovengrens van normaal.
Na stopzetting van de behandeling met Valdoxan moeten leverfunctietesten worden herhaald totdat de serumtransaminasespiegels weer normaal zijn.
Gebruik bij pediatrische patiënten
Valdoxan wordt niet aanbevolen voor de behandeling van depressie bij patiënten jonger dan 18 jaar, aangezien de veiligheid en werkzaamheid van Valdoxan in deze leeftijdsgroep niet zijn geëvalueerd. en vijandige houding (voornamelijk agressief, oppositioneel en boos gedrag) (zie rubriek 4.2).
Oudere patiënten
Er zijn geen gedocumenteerde effecten van agomelatine bij patiënten ≥ 75 jaar, daarom mag agomelatine niet worden gebruikt bij patiënten in deze leeftijdsgroep (zie ook rubrieken 4.2 en 5.1).
Gebruik bij oudere patiënten met dementie
Valdoxan mag niet worden gebruikt voor de behandeling van depressieve episodes bij oudere patiënten met dementie, aangezien de veiligheid en werkzaamheid van Valdoxan bij deze patiënten niet zijn beoordeeld.
Bipolaire stoornis / manie / hypomanie
Valdoxan moet met voorzichtigheid worden gebruikt bij patiënten met een voorgeschiedenis van bipolaire stoornis, manie of hypomanie en moet worden stopgezet als een patiënt manische symptomen ontwikkelt (zie rubriek 4.8).
Zelfmoord / zelfmoordgedachten
Depressie gaat gepaard met een verhoogd risico op zelfmoordgedachten, zelfverwonding en zelfmoord (zelfmoordgerelateerde gebeurtenissen). Dit risico blijft bestaan totdat significante remissie optreedt. Aangezien er mogelijk geen verbetering optreedt tijdens de eerste of volgende weken van de behandeling, moeten patiënten nauwlettend worden gevolgd totdat verbetering optreedt. Het is algemene klinische ervaring dat het risico op zelfmoord vroeg in het genezingsproces kan toenemen.
Van patiënten met een voorgeschiedenis van aan zelfmoord gerelateerde gebeurtenissen, of die een significante mate van zelfmoordgedachten vertonen voorafgaand aan de start van de behandeling, is bekend dat ze een hoger risico lopen op zelfmoordgedachten of zelfmoordpogingen, en moeten tijdens de behandeling nauwlettend worden gecontroleerd. analyse van klinische onderzoeken uitgevoerd met antidepressiva vergeleken met placebo bij de behandeling van psychiatrische stoornissen toonde een verhoogd risico op suïcidaal gedrag aan bij patiënten jonger dan 25 jaar die werden behandeld met antidepressiva in vergelijking met placebo.
De behandeling moet gepaard gaan met nauwlettende bewaking van patiënten, met name die met een hoog risico, vooral in de vroege stadia van de behandeling en na dosisaanpassingen. Patiënten (en zorgverleners) moeten worden geïnformeerd over de noodzaak om te controleren op verslechtering van het klinische beeld, suïcidaal gedrag of zelfmoordgedachten en ongewone gedragsveranderingen en om onmiddellijk medische hulp in te roepen als deze symptomen optreden.
Combinatie met CYP1A2-remmers (zie rubrieken 4.3 en 4.5)
Voorzichtigheid is geboden bij het voorschrijven van Valdoxan met matige CYP1A2-remmers (bijv. propranolol, enoxacine), wat kan leiden tot een verhoogde blootstelling aan agomelatine.
Lactose intolerantie
Valdoxan bevat lactose. Patiënten met zeldzame erfelijke aandoeningen als galactose-intolerantie, Lapp-lactasedeficiëntie of glucose-galactosemalabsorptie dienen dit geneesmiddel niet te gebruiken.
04.5 Interacties met andere geneesmiddelen en andere vormen van interactie
Mogelijke interacties met agomelatine
Agomelatine wordt voornamelijk gemetaboliseerd door cytochroom P450 1A2 (CYP1A2) (90%) en CYP2C9/19 (10%). Geneesmiddelen die een wisselwerking hebben met deze iso-enzymen kunnen de biologische beschikbaarheid van agomelatine verminderen of verhogen.
Fluvoxamine, een krachtige remmer van CYP1A2 en matige remmer van CYP2C9, remt duidelijk het metabolisme van agomelatine, wat resulteert in een 60-voudige (bereik 12-412) toename van de blootstelling aan agomelatine.
Daarom is gelijktijdige toediening van Valdoxan met krachtige CYP1A2-remmers (bijv. fluvoxamine, ciprofloxacine) gecontra-indiceerd.
De combinatie van agomelatine met oestrogeen (matige remmers van CYP1A2) resulteert in een meervoudige toename van de blootstelling aan agomelatine. Hoewel er geen specifiek bewijs met betrekking tot geneesmiddelveiligheid werd gevonden bij de 800 patiënten die werden behandeld in combinatie met oestrogeen, is voorzichtigheid geboden bij het voorschrijven van agomelatine met andere matige CYP1A2-remmers (bijv. propranolol, enoxacine) totdat meer ervaring is opgedaan (zie rubriek 4.4).
Rifampicine, een inductor van alle drie de cytochromen die betrokken zijn bij het metabolisme van agomelatine, kan de biologische beschikbaarheid van agomelatine verminderen.
Roken induceert CYP1A2 en het is aangetoond dat het de biologische beschikbaarheid van agomelatine vermindert, vooral bij zware rokers (≥15 sigaretten/dag) (zie rubriek 5.2).
Mogelijke interacties van agomelatine met andere geneesmiddelen
In vivo, agomelatine induceert geen CYP450-iso-enzymen. Agomelatine remt ook niet CYP1A2 in vivo, noch de CYP450 in vitro. Daarom heeft agomelatine geen invloed op de blootstelling aan geneesmiddelen die worden gemetaboliseerd door CYP450.
Geneesmiddelen sterk gebonden aan plasma-eiwitten
Agomelatine verandert niets aan de vrije concentratie van geneesmiddelen die sterk gebonden zijn aan plasma-eiwitten of vice versa.
Interacties met andere geneesmiddelen
In klinische fase I-onderzoeken werden geen farmacokinetische of farmacodynamische interacties waargenomen met geneesmiddelen die gelijktijdig met Valdoxan zouden kunnen worden voorgeschreven aan de doelpopulatie, zoals benzodiazepinen, lithium, paroxetine, fluconazol en theofylline.
Alcohol
De combinatie van Valdoxan met alcohol wordt niet aanbevolen.
Elektroconvulsietherapie (ECT)
Er is geen ervaring met het gecombineerde gebruik van agomelatine met ECT Dierstudies hebben geen proconvulsieve eigenschappen aangetoond (zie rubriek 5.3) Daarom worden klinische gevolgen van gelijktijdige behandeling met ECT en agomelatine onwaarschijnlijk geacht.
Pediatrische populatie
Interactiestudies zijn alleen bij volwassenen uitgevoerd.
04.6 Zwangerschap en borstvoeding
Zwangerschap
Gegevens over het gebruik van agomelatine bij zwangere vrouwen bestaan niet of zijn beperkt (minder dan 300 blootgestelde zwangerschappen). Dierstudies wijzen niet op directe of indirecte schadelijke effecten op de zwangerschap, de embryonale/foetale ontwikkeling, de bevalling of de postontwikkeling. -nataal (zie rubriek 5.3) Uit voorzorg verdient het de voorkeur om het gebruik van Valdoxan tijdens de zwangerschap te vermijden.
Voedertijd
Het is niet bekend of agomelatine/metabolieten in de moedermelk worden uitgescheiden. Uit beschikbare farmacodynamische/toxicologische gegevens bij dieren blijkt dat agomelatine/metabolieten in melk worden uitgescheiden (zie rubriek 5.3). Een risico voor pasgeborenen/zuigelingen kan niet worden uitgesloten. Er moet worden besloten of de borstvoeding moet worden gestaakt of dat de behandeling moet worden gestaakt. / zich onthouden van behandeling met Valdoxan, waarbij het voordeel van borstvoeding voor het kind en het voordeel van therapie voor de vrouw in overweging moeten worden genomen.
Vruchtbaarheid
Reproductieonderzoeken bij ratten en konijnen lieten geen effecten zien van agomelatine op de vruchtbaarheid (zie rubriek 5.3).
04.7 Beïnvloeding van de rijvaardigheid en het vermogen om machines te bedienen
Er is geen onderzoek gedaan naar de rijvaardigheid en het vermogen om machines te bedienen.
Aangezien duizeligheid en slaperigheid vaak voorkomende bijwerkingen zijn, moeten patiënten echter worden geadviseerd aandacht te besteden aan hun rijvaardigheid of het vermogen om machines te bedienen.
04.8 Bijwerkingen
Samenvatting van het veiligheidsprofiel
In klinische onderzoeken kregen meer dan 7.900 depressieve patiënten Valdoxan.
Bijwerkingen waren gewoonlijk licht of matig en traden op tijdens de eerste twee weken van de behandeling. De meest voorkomende bijwerkingen waren misselijkheid en duizeligheid. Deze bijwerkingen waren gewoonlijk van voorbijgaande aard en leidden in het algemeen niet tot stopzetting van de behandeling.
Tabel met bijwerkingen
Bijwerkingen worden hieronder vermeld volgens de volgende conventie: zeer vaak (≥1/10); gemeenschappelijk (≥1 / 100,
* Frequentie geschat op basis van klinische onderzoeken voor bijwerkingen gemeld uit spontane meldingen
sommige gevallen met fatale afloop of levertransplantatie zijn uitzonderlijk gemeld bij patiënten met risicofactoren voor de lever
Melding van vermoedelijke bijwerkingen
Het melden van vermoedelijke bijwerkingen die optreden na toelating van het geneesmiddel is belangrijk, omdat het een continue controle van de baten/risicoverhouding van het geneesmiddel mogelijk maakt.Beroepsbeoefenaren in de gezondheidszorg wordt verzocht alle vermoedelijke bijwerkingen te melden via de website: www.Agenziafarmaco.gov. it/it/responsabili van het Italiaanse Geneesmiddelenbureau.
04.9 Overdosering
Symptomen
Ervaring met overdosering met agomelatine is beperkt Ervaring met overdosering met agomelatine heeft melding gemaakt van epigastralgie, slaperigheid, vermoeidheid, opwinding, angst, spanning, duizeligheid, cyanose of malaise. Een persoon die 2450 mg agomelatine had ingenomen, herstelde spontaan zonder cardiovasculaire en biologische afwijkingen.
Beheer
Er zijn geen specifieke antidota bekend voor agomelatine. Behandeling van overdosering dient te bestaan uit behandeling van klinische symptomen en routinematige controle. Medische hulp in een gespecialiseerde setting wordt aanbevolen.
05.0 FARMACOLOGISCHE EIGENSCHAPPEN
05.1 Farmacodynamische eigenschappen
Farmacotherapeutische categorie: psychoanaleptica, andere antidepressiva.
ATC-code: N06AX22.
Werkingsmechanisme
Agomelatine is een melatonerge agonist (MT1- en MT2-receptoren) en een 5-HT2C-receptorantagonist. Bindingsonderzoeken geven aan dat agomelatine geen effect heeft op de opname van monoamine en geen affiniteit heeft voor a-, b-adrenerge, histaminerge, cholinerge, dopaminerge en benzodiazepine-receptoren.
Agomelatine resynchroniseert circadiane ritmes in diermodellen van circadiane ritmeverandering. Agomelatine verhoogt de afgifte van noradrenaline en dopamine, met name in de frontale cortex, en heeft geen invloed op de extracellulaire niveaus van serotonine.
Farmacodynamische effecten
Agomelatine vertoonde een antidepressivum-achtig effect in diermodellen van depressie (aangeleerde hulpeloosheidstest, wanhoopstest, chronische milde stress) evenals in modellen met desynchronisatie van het circadiane ritme en in modellen gerelateerd aan stress en angst.
Bij mensen heeft Valdoxan positieve faseverschuivingseigenschappen; het induceert een faseverloop van de slaap, een verlaging van de lichaamstemperatuur en het begin van de melatonineproductie.
Klinische werkzaamheid en veiligheid
De werkzaamheid en veiligheid van Valdoxan bij depressieve episodes zijn onderzocht in een klinisch programma met 7.900 patiënten die met Valdoxan werden behandeld.
Er zijn tien placebogecontroleerde onderzoeken uitgevoerd om de werkzaamheid op korte termijn van Valdoxan bij depressieve stoornis bij volwassenen te onderzoeken, bij een vaste dosis en/of dosistitratie.Aan het einde van de behandeling (na 6 of 8 weken) is een significante werkzaamheid van agomelatine 25-50 mg in zes van de tien kortlopende, dubbelblinde, placebogecontroleerde onderzoeken. Het primaire eindpunt was de verandering in HAMD-17-score ten opzichte van baseline. Agomelatine onderscheidde zich niet van placebo in twee onderzoeken waarin de actieve controle, paroxetine of fluoxetine, gevoeligheid voor de test vertoonde. Agomelatine werd niet direct vergeleken met paroxetine en fluoxetine als deze vergelijkende geneesmiddelen werden toegevoegd om de testgevoeligheid in de onderzoeken te verzekeren. In twee andere onderzoeken kon geen conclusie worden getrokken omdat de twee actieve controles, paroxetine of fluoxetine, niet verschilden van placebo In deze onderzoeken was het echter niet mogelijk om de aanvangswaarde te verhogen dosis van ofwel agomelatine, paroxetine of fluoxetine, hoewel de respons niet voldoende was.
In alle positieve placebogecontroleerde onderzoeken werd ook werkzaamheid gezien bij patiënten met een ernstigere depressie (initiële HAM-D-score ≥ 25).
De responspercentages waren statistisch significant hoger met Valdoxan dan met placebo.
Superioriteit (2 onderzoeken) of non-inferioriteit (4 onderzoeken) werd aangetoond in 6 van de 7 werkzaamheidsonderzoeken die werden uitgevoerd bij heterogene populaties van volwassen patiënten die depressief waren ten opzichte van SSRI/SNRI (sertraline, escitalopram, fluoxetine, venlafaxine of duloxetine). Het antidepressieve effect werd beoordeeld met de HAMD-17-score, gebruikt als primair of secundair eindpunt.
De werkzaamheid van de antidepressiva werd aangetoond in een onderzoek naar terugvalpreventie.Patiënten die reageerden op 8/10 weken acute open-label behandeling met 25-50 mg Valdoxan eenmaal daags werden gerandomiseerd naar 25-50 mg Valdoxan eenmaal daags of placebo voor een extra 6 maanden Toediening van eenmaal daags 25-50 mg Valdoxan toonde statistisch significante superioriteit ten opzichte van placebo (p = 0,0001) op de primaire uitkomstmaat, preventie van depressieve terugvallen, geëvalueerd als tijd tot terugval. De incidentie van recidieven tijdens de dubbelblinde follow-upperiode van 6 maanden was respectievelijk 22% voor Valdoxan en 47% voor placebo.
Valdoxan heeft geen invloed op de alertheid en het geheugen overdag bij gezonde vrijwilligers. Bij depressieve patiënten verhoogde de behandeling met Valdoxan 25 mg de langzame-golfslaapfase zonder de hoeveelheid REM-slaap te veranderen (Snelle oog beweging) of REM-slaaplatentie. Valdoxan 25 mg veroorzaakte ook een vroeg begin van de slaap en een verhoging van de minimale hartslag.Zoals beoordeeld door de patiënten zelf, verbeterden het begin en de kwaliteit van de slaap significant, te beginnen in de eerste week van de behandeling zonder slaperigheid overdag te veroorzaken.
In een specifiek vergelijkend onderzoek naar seksuele disfunctie, uitgevoerd bij patiënten die remissie van een depressie hadden bereikt, was er een neiging tot een lagere frequentie van seksuele disfunctie toegeschreven aan Valdoxan in vergelijking met venlafaxine (statistisch niet significant) voor opwinding of opwindingsscores. de Schaal voor sekseffecten (SEXFX). De "gecombineerde analyse van de onderzoeken met behulp van de"Arizona Seksuele Ervaringsschaal (ASEX) heeft aangetoond dat Valdoxan niet geassocieerd is met seksuele disfunctie. Bij gezonde vrijwilligers handhaaft Valdoxan de seksuele functie ongewijzigd in vergelijking met paroxetine.
In klinische onderzoeken liet Valdoxan geen enkel effect zien op de hartslag en bloeddruk.
In een onderzoek dat was opgezet om ontwenningsverschijnselen te evalueren met behulp van de checklist voor ontwenningsverschijnselen bij patiënten die remissie van depressie hadden bereikt, veroorzaakte Valdoxan geen ontwenningssyndroom na plotselinge stopzetting van de behandeling.
Valdoxan heeft geen potentieel voor misbruik, zoals is vastgesteld in onderzoeken die zijn uitgevoerd bij gezonde vrijwilligers met behulp van een specifieke visuele analoge schaal of met de "Verslaving Onderzoekscentrum Inventaris (ARCI) voor 49 stemmen.
Een 8 weken durende placebogecontroleerde studie met agomelatine 25-50 mg/dag bij oudere depressieve patiënten (≥ 65 jaar, N = 222, van wie 151 behandeld met agomelatine) toonde een statistisch significant verschil van 2,67 punten in de HAM-D totaalscore , primaire uitkomst. De frequentie van responsanalyse is in het voordeel van agomelatine.
Gegevens over zeer oudere patiënten (≥ 75 jaar, N = 69 van wie 48 behandeld met agomelatine) zijn echter beperkt. De verdraagbaarheid van agomelatine bij oudere patiënten is vergelijkbaar met die bij jonge volwassenen.
Een specifieke, gecontroleerde studie van 3 weken werd uitgevoerd bij patiënten met een depressieve stoornis en met onvoldoende verbetering tijdens behandeling met paroxetine (een SSRI) of venlafaxine (een SNRI). Wanneer de behandeling werd overgeschakeld van deze antidepressiva naar agomelatine, traden ontwenningsverschijnselen op na stopzetting van de SSRI- of SNRI-behandeling, of dit nu abrupte of geleidelijke stopzetting van een eerdere behandeling was. Deze ontwenningsverschijnselen kunnen worden verward met een gebrek aan vroege voordelen van agomelatine.
Het percentage patiënten met ten minste één ontwenningssymptoom één week na het stoppen van de SSRI/SNRI-behandeling was lager in de groep met afbouw van de lange dosis (afbouw van eerdere SSRI/SNRI gedurende 2 weken) dan in de korte dosisverlaging (geleidelijk stopzetten van de vorige SSRI / SNRI in 1 week) en in de onmiddellijke vervangingsgroep (abrupte stopzetting): respectievelijk 56,1%, 62,6% en 79,8%.
Pediatrische populatie
Het Europees Geneesmiddelenbureau heeft besloten tot uitstel van de verplichting voor de fabrikant om de resultaten in te dienen van onderzoek met Valdoxan in een of meerdere subgroepen van pediatrische patiënten voor de behandeling van depressieve episodes (zie rubriek 4.2 voor informatie over pediatrisch gebruik).
05.2 "Farmacokinetische eigenschappen
Absorptie en biologische beschikbaarheid
Agomelatine wordt na orale toediening goed en snel geabsorbeerd (≥ 80%). De absolute biologische beschikbaarheid is laag (orale anticonceptiva en neemt af door roken. De piekplasmaconcentratie wordt binnen 1-2 uur bereikt.
Systemische blootstelling aan agomelatine over het therapeutische dosisbereik lijkt evenredig toe te nemen met de dosis.Bij hogere doses is er verzadiging van het first-pass-effect.
Voedselinname (een standaardmaaltijd of een vetrijke maaltijd) verandert de biologische beschikbaarheid of de absorptiesnelheid niet.De variabiliteit wordt verhoogd door vetrijke voedingsmiddelen.
Verdeling
Het distributievolume bij steady-state is ongeveer 35 l en de plasma-eiwitbinding is 95% ongeacht de concentratie, en verandert niet met de leeftijd en bij patiënten met nierfunctiestoornis, maar de vrije fractie wordt verdubbeld bij patiënten met leverfunctiestoornis.
Biotransformatie
Na orale toediening wordt agomelatine snel gemetaboliseerd, voornamelijk door het hepatische cytochroom CYP1A2. CYP2C9 en CYP2C19 iso-enzymen zijn minimaal betrokken.
De belangrijkste metabolieten, gehydroxyleerde en gedemethyleerde agomelatine, zijn inactief en worden snel geconjugeerd en geëlimineerd in de urine.
Eliminatie
De eliminatie is snel, de gemiddelde plasmahalfwaardetijd ligt tussen 1 en 2 uur, en de klaring is hoog (ongeveer 1.100 ml/min) en hoofdzakelijk metabool.
De excretie is voornamelijk urinair (80%) en bestaat uit de metabolieten, terwijl de urinaire dosering van de onveranderde stof verwaarloosbaar is.
De kinetiek verandert niet na herhaalde toediening.
Nierfunctiestoornis
Er werden geen significante veranderingen in farmacokinetische parameters waargenomen bij patiënten met ernstige nierinsufficiëntie (n = 8, enkelvoudige dosis van 25 mg), maar voorzichtigheid is geboden bij patiënten met ernstige of matige nierinsufficiëntie aangezien er slechts beperkte klinische gegevens beschikbaar zijn voor deze patiënten ( zie paragraaf 4.2).
leverfunctiestoornis
In een specifiek onderzoek bij patiënten met cirrose met chronische lichte (Child-Pugh type A) of matige (Child-Pugh type B) leverinsufficiëntie, was de blootstelling aan 25 mg agomelatine significant verhoogd (respectievelijk 70 en 140 keer) vergeleken met vergelijkbare vrijwilligers (voor leeftijd, gewicht en rookgewoonten) zonder leverfunctiestoornis (zie rubrieken 4.2, 4.3 en 4.4).
Oudere patiënten
In een farmacokinetisch onderzoek bij oudere patiënten (≥ 65 jaar) werd aangetoond dat bij een dosis van 25 mg de mediane AUC en mediane Cmax ongeveer 4 maal en 13 maal hoger waren bij patiënten ≥ 75 jaar dan bij patiënten. oud
Etnische groeperingen
Er zijn geen gegevens beschikbaar over de invloed van ras op de farmacokinetiek van agomelatine.
05.3 Gegevens uit het preklinisch veiligheidsonderzoek
Bij hoge doses werden sedatieve effecten waargenomen bij muizen, ratten en apen na enkelvoudige en herhaalde toediening.
Bij knaagdieren was er een duidelijke inductie van CYP2B en een matige inductie van CYP1A en CYP3A vanaf 125 mg/kg/dag, terwijl bij apen de inductie mild was voor CYP2B en CYP3A bij 375 mg/kg/dag. knaagdieren en apen werd geen hepatotoxiciteit waargenomen.
Agomelatine gaat over in de placenta en foetussen van zwangere vrouwelijke ratten.
Reproductiestudies bij ratten en konijnen lieten geen effecten zien van agomelatine op de vruchtbaarheid, embryonale/foetale ontwikkeling en pre- en postnatale ontwikkeling.
Een reeks standaard genotoxiciteitstesten in vitro En in vivo toonde de afwezigheid van mutageen of clastogeen potentieel van agomelatine aan.
In carcinogeniteitsstudies induceerde agomelatine een verhoogde incidentie van levertumoren bij ratten en muizen bij doses die ten minste 110 keer hoger waren dan de therapeutische dosis Levertumoren zijn hoogstwaarschijnlijk gerelateerd aan knaagdierspecifieke enzyminductie. De waargenomen frequentie van goedaardige borstfibroadenomen bij ratten nam toe bij hoge doses (60 maal de therapeutische dosis), maar bleef binnen het controlebereik.
Farmacologische veiligheidsstudies hebben geen effecten aangetoond van agomelatine op humane Ether a-go-go Related Gene (hERG)-stromen of op de actiepotentialen van Purkinje-cellen bij honden. Agomelatine vertoonde geen proconvulsieve eigenschappen bij ip-doses tot 128 mg/kg bij muizen en ratten.
Er werden geen effecten van agomelatine waargenomen op het gedrag, de reproductieve en visuele functies van jonge dieren. Er waren kleine, dosisonafhankelijke afnames van het lichaamsgewicht gerelateerd aan farmacologische eigenschappen en enkele kleine effecten op het mannelijke voortplantingsstelsel zonder verminderde reproductieve functie.
06.0 FARMACEUTISCHE INFORMATIE
06.1 Hulpstoffen
Tabletkern:
- Lactosemonohydraat
- Maïszetmeel
- Povidon K 30
- Natriumzetmeelglycolaat type A
- Stearinezuur
- Magnesium stearaat
- Watervrij colloïdaal silica.
Coatingfilm:
- Hypromellose
- Geel ijzeroxide (E172)
- Glycerol
- Macrogol 6000
- Magnesium stearaat
- Titaandioxide (E171).
Drukinkt met schellak, propyleenglycol en indigokarmijnaluminiumlak (E132).
06.2 Incompatibiliteit
Niet relevant.
06.3 Geldigheidsduur
3 jaar.
06.4 Speciale voorzorgsmaatregelen bij bewaren
Voor dit geneesmiddel zijn er geen speciale bewaarcondities.
06.5 Aard van de primaire verpakking en inhoud van de verpakking
Aluminium/PVC blisterverpakkingen verpakt in kartonnen dozen (kalender).
Verpakkingen met 7, 14, 28, 42, 56, 84 en 98 filmomhulde tabletten.
Verpakkingen van 100 filmomhulde tabletten voor gebruik in het ziekenhuis.
Mogelijk worden niet alle verpakkingsgrootten in de handel gebracht.
06.6 Instructies voor gebruik en verwerking
Geen speciale instructies voor verwijdering.
07.0 HOUDER VAN DE VERGUNNING VOOR HET IN DE HANDEL BRENGEN
Les Laboratoires Servier
50, rue Carnot
92284 Suresnes cedex
Frankrijk
08.0 NUMMER VAN DE VERGUNNING VOOR HET IN DE HANDEL BRENGEN
EU / 1/08/499 / 001-008
039143019
039143021
039143045
039143058
039143060
039143072
039143084
A.I.C. nr. 039143033 / E - pak van 28 tabletten
09.0 DATUM VAN EERSTE VERGUNNING OF VERLENGING VAN DE VERGUNNING
Datum eerste vergunning: 19 februari 2009
Datum van meest recente verlenging: 19 februari 2014
10.0 DATUM VAN HERZIENING VAN DE TEKST
11/2014