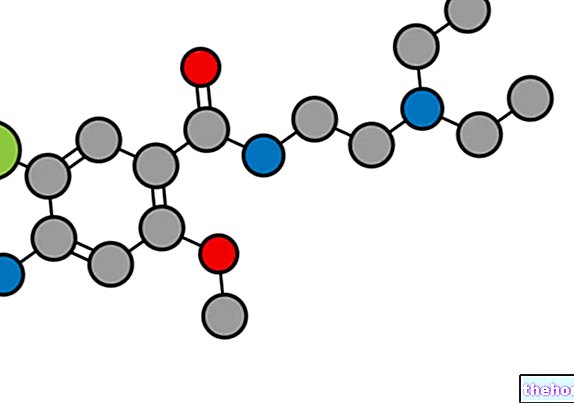
Actieve ingrediënten: Deferasirox
EXJADE 125 mg dispergeerbare tabletten
EXJADE 250 mg dispergeerbare tabletten
EXJADE 500 mg dispergeerbare tabletten
Exjade bijsluiters zijn beschikbaar voor verpakkingsgrootten: - EXJADE 125 mg dispergeerbare tabletten, EXJADE 250 mg dispergeerbare tabletten, EXJADE 500 mg dispergeerbare tabletten
- EXJADE 90 mg filmomhulde tabletten, EXJADE 180 mg filmomhulde tabletten, EXJADE 360 mg filmomhulde tabletten
Waarom wordt Exjade gebruikt? Waar is het voor?
Wat is EXJADE
EXJADE bevat de werkzame stof deferasirox. Het is een ijzerchelator, een geneesmiddel dat wordt gebruikt om overtollig ijzer uit het lichaam te verwijderen (ijzerstapeling).Deferasirox bindt zich aan overtollig ijzer en verwijdert het door het voornamelijk in de ontlasting te elimineren.
Waar is EXJADE voor?
Bij patiënten met verschillende vormen van bloedarmoede (bijvoorbeeld thalassemie, sikkelcelanemie of myelodysplastische syndromen (MDS) kunnen herhaalde bloedtransfusies nodig zijn. Deze kunnen echter een teveel aan ijzer in het lichaam veroorzaken. Dit komt doordat het bloed ijzer in het lichaam heeft geen natuurlijke manier om overtollig ijzer te verwijderen dat door bloedtransfusies is ingebracht Bij patiënten met thalassemiesyndromen die geen bloedtransfusies krijgen, kan zich in de loop van de tijd ook een ijzerstapeling ontwikkelen, voornamelijk als gevolg van een verhoogde bloeddruk. tot een laag aantal bloedcellen Na verloop van tijd kan een teveel aan ijzer belangrijke organen zoals de lever en het hart beschadigen Medicijnen die ijzerchelatoren worden genoemd, worden gebruikt om ijzer te elimineren overtollig ijzer en verminderen het risico dat dit bepaalde organen kan beschadigen.
EXJADE wordt gebruikt voor de behandeling van ijzerstapeling als gevolg van frequente bloedtransfusies bij patiënten van 6 jaar en ouder met bèta-thalassemie major.
EXJADE wordt ook gebruikt voor de behandeling van ijzerstapeling wanneer deferoxaminetherapie gecontra-indiceerd of ontoereikend is bij patiënten met bèta-thalassemie major met ijzerstapeling als gevolg van onregelmatige bloedtransfusies, bij patiënten met andere vormen van bloedarmoede en bij kinderen tussen 2 en 5 jaar. .
EXJADE wordt ook gebruikt wanneer behandeling met deferoxamine gecontra-indiceerd of ontoereikend is voor de behandeling van patiënten van 10 jaar en ouder met ijzerstapeling geassocieerd met thalassemiesyndromen, maar die geen bloedtransfusie nodig hebben.
Contra-indicaties Wanneer Exjade niet mag worden gebruikt
Gebruik EXJADE niet
- als u allergisch bent voor deferasirox of voor één van de andere bestanddelen van dit geneesmiddel. Als dit op u van toepassing is, vertel dit dan aan uw arts voordat u EXJADE inneemt. Als u denkt dat u allergisch bent, vraag dan uw arts om advies.
- als u een matige of ernstige nierziekte heeft.
- als u momenteel andere ijzerchelerende geneesmiddelen gebruikt.
EXJADE wordt niet aanbevolen
- als u zich in een vergevorderd stadium van het myelodysplastisch syndroom bevindt (MDS: verminderde aanmaak van bloedcellen door het beenmerg) of als u gevorderde kanker heeft.
Voorzorgsmaatregelen bij gebruik Wat u moet weten voordat u Exjade inneemt
Neem contact op met uw arts of apotheker voordat u EXJADE inneemt:
- als u een nier- of leverprobleem heeft.
- als u een hartprobleem heeft door ijzerstapeling.
- als u een duidelijke vermindering van uw urineproductie bemerkt (teken van een nierprobleem).
- als u ernstige huiduitslag of ademhalingsmoeilijkheden heeft en duizeligheid of zwelling, vooral van het gezicht en de keel (tekenen van een ernstige allergische reactie).
- als u huiduitslag, rode huid, blaarvorming op de lippen, ogen of mond, vervellen van de huid, koorts heeft (tekenen van een ernstige huidreactie)
- als u last krijgt van een combinatie van slaperigheid, pijn in de rechter bovenbuik, geel worden of meer geel worden van de huid of ogen en donkere urine (tekenen van leverproblemen).
- als u bloed overgeeft en/of zwarte ontlasting heeft.
- als u vaak buikpijn heeft, vooral na het eten of het innemen van EXJADE.
- als u vaak last heeft van brandend maagzuur.
- als u een laag aantal bloedplaatjes of witte bloedcellen heeft bij bloedonderzoeken.
- als u wazig ziet.
- als u diarree of braken heeft.
Als een van deze situaties op u van toepassing is, vertel dit dan onmiddellijk aan uw arts.
Controle van de behandeling met EXJADE
Tijdens uw behandeling zult u regelmatig bloed- en urineonderzoeken ondergaan. Zij zullen de hoeveelheid ijzer in uw lichaam (ferritinegehalte in uw bloed) controleren om te zien hoe EXJADE werkt. De tests zullen ook de nierfunctie (bloedcreatininespiegel, aanwezigheid van eiwit in de urine) en leverfunctie (bloedtransaminasespiegel) controleren. Uw arts kan u vragen om een nierbiopsie te ondergaan als hij of zij aanzienlijke nierbeschadiging vermoedt. De lever kan ook worden onderworpen aan MRI-tests (magnetic resonance imaging) om de hoeveelheid ijzer in de lever te bepalen. Uw arts zal deze tests evalueren om te beslissen welke dosis EXJADE voor u het meest geschikt is en hij zal deze tests ook gebruiken om te beslissen wanneer u moet stoppen met het gebruik van EXJADE.
Uit voorzorg wordt uw zicht en gehoor jaarlijks tijdens de behandeling onderzocht.
Interacties Welke medicijnen of voedingsmiddelen kunnen het effect van Exjade veranderen?
Vertel het uw arts of apotheker als u andere geneesmiddelen gebruikt, kort geleden heeft gebruikt of in de nabije toekomst gaat gebruiken. Dit geldt in het bijzonder voor:
- andere ijzerchelatoren, die niet met EXJADE mogen worden ingenomen,
- antacida (geneesmiddelen voor de behandeling van brandend maagzuur) die aluminium bevatten en die niet op hetzelfde tijdstip van de dag met EXJADE mogen worden ingenomen,
- ciclosporine (gebruikt om afstoting van een getransplanteerd orgaan te voorkomen of voor andere aandoeningen zoals reumatoïde artritis of atopische dermatitis),
- simvastatine (gebruikt om cholesterol te verlagen),
- sommige pijnstillers of ontstekingsremmende geneesmiddelen (bijv. aspirine, ibuprofen, corticosteroïden),
- orale bisfosfonaten (gebruikt om osteoporose te behandelen),
- anticoagulantia (gebruikt om bloedstolling te voorkomen of te behandelen),
- hormonale anticonceptiva (anticonceptiemiddelen),
- bepridil, ergotamine (gebruikt bij hartproblemen en migraine),
- repaglinide (gebruikt voor de behandeling van diabetes),
- rifampicine (gebruikt voor de behandeling van tuberculose),
- fenytoïne, fenobarbital, carbamazepine (gebruikt voor de behandeling van epilepsie),
- ritonavir (gebruikt voor de behandeling van hiv-infectie),
- paclitaxel (gebruikt bij de behandeling van kanker),
- theofylline (gebruikt voor de behandeling van aandoeningen van de luchtwegen zoals astma),
- clozapine (gebruikt voor de behandeling van psychiatrische stoornissen zoals schizofrenie)
- tizanidine (gebruikt als spierverslapper),
- colestyramine (gebruikt om het cholesterolgehalte in het bloed te verlagen).
Aanvullende tests kunnen nodig zijn om de bloedspiegels van sommige van deze geneesmiddelen te controleren.
Waarschuwingen Het is belangrijk om te weten dat:
Ouderen (65 jaar of ouder)
EXJADE kan door mensen van 65 jaar en ouder worden gebruikt in dezelfde dosis als bij volwassenen. Oudere patiënten kunnen meer bijwerkingen krijgen (vooral diarree) dan jongere patiënten. Ze dienen nauwlettend door uw arts te worden gecontroleerd op bijwerkingen waarvoor een dosisaanpassing nodig kan zijn.
Kinderen en adolescenten
EXJADE kan worden gebruikt bij kinderen en adolescenten die regelmatig bloedtransfusies krijgen van 2 jaar en ouder en bij kinderen en adolescenten die niet regelmatig bloedtransfusies krijgen van 10 jaar en ouder. De arts zal de dosis aanpassen op basis van de groei van de patiënt
EXJADE wordt niet aanbevolen voor kinderen jonger dan 2 jaar.
Zwangerschap en borstvoeding
Als u zwanger bent of borstvoeding geeft, denkt zwanger te zijn of zwanger wilt worden, vraag dan uw arts om advies voordat u dit geneesmiddel inneemt.
EXJADE wordt niet aanbevolen tijdens de zwangerschap, tenzij strikt noodzakelijk.
Als u momenteel een oraal anticonceptivum of een anticonceptiepleister gebruikt om zwangerschap te voorkomen, moet u een extra of ander type anticonceptie gebruiken (bijv. condooms), omdat EXJADE de werkzaamheid van orale en pleisteranticonceptiva kan verminderen.
Borstvoeding wordt niet aanbevolen tijdens de behandeling met EXJADE.
Rijvaardigheid en het gebruik van machines
Als u zich duizelig voelt nadat u EXJADE heeft ingenomen, rijd dan niet en gebruik geen gereedschap of machines totdat u zich niet meer duizelig voelt.
EXJADE bevat lactose
Als uw arts u heeft verteld dat u bepaalde suikers niet verdraagt, neem dan contact op met uw arts voordat u dit geneesmiddel inneemt.
Dosis, wijze en tijdstip van toediening Hoe Exjade te gebruiken: Dosering
Behandeling met EXJADE zal plaatsvinden onder toezicht van een arts die ervaring heeft met de behandeling van ijzerstapeling veroorzaakt door bloedtransfusies.
Gebruik dit geneesmiddel altijd precies zoals uw arts u dat heeft verteld. Raadpleeg bij twijfel uw arts of apotheker.
Hoeveel EXJADE te nemen?
- De dosis EXJADE is voor alle patiënten afhankelijk van het lichaamsgewicht. Uw arts zal de dosis bepalen die u nodig heeft en u vertellen hoeveel tabletten u per dag moet innemen.
- De gebruikelijke dagelijkse dosis EXJADE dispergeerbare tabletten aan het begin van de behandeling voor patiënten die regelmatig bloedtransfusies krijgen, is 20 mg per kilogram lichaamsgewicht Uw arts kan een hogere of lagere startdosis aanbevelen op basis van de behoefte aan individuele behandeling.
- De gebruikelijke dagelijkse dosis EXJADE dispergeerbare tabletten aan het begin van de behandeling voor patiënten die niet regelmatig bloedtransfusies krijgen, is 10 mg per kilogram lichaamsgewicht.
- Afhankelijk van hoe u op de behandeling reageert, kan uw arts uw behandeling vervolgens wijzigen door de dosis te verhogen of te verlagen.
- De maximale aanbevolen dagelijkse dosis van EXJADE dispergeerbare tabletten is 40 mg per kilogram lichaamsgewicht voor patiënten die regelmatig bloedtransfusies krijgen, 20 mg per kilogram lichaamsgewicht voor volwassen patiënten die geen regelmatige bloedtransfusies krijgen en 10 mg per kilogram lichaamsgewicht voor kinderen en adolescenten die niet regelmatig bloedtransfusies krijgen.
Deferasirox is ook verkrijgbaar als "filmomhulde" tabletten. Als u overstapt van de filmomhulde tabletten naar deze dispergeerbare tabletten, is een dosisaanpassing vereist.
Wanneer moet EXJADE worden ingenomen?
- Neem EXJADE eenmaal per dag, elke dag, elke dag op ongeveer hetzelfde tijdstip in.
- Neem EXJADE dispergeerbare tabletten op een lege maag in.
- Wacht dus minstens 30 minuten voordat u iets eet. Als u EXJADE elke dag op hetzelfde tijdstip inneemt, kunt u er ook aan herinneren wanneer u uw tabletten moet innemen.
Hoe wordt EXJADE ingenomen?
- Laat de tablet(ten) in een glas water, of appel- of sinaasappelsap (100-200 ml) vallen.
- Meng totdat de tablet(ten) volledig zijn opgelost. In het glas zal de vloeistof troebel lijken.
- Drink de hele inhoud van het glas op. Voeg vervolgens wat water of sap toe aan het residu in het glas, roer en drink opnieuw.
Los de tabletten niet op in koolzuurhoudende dranken of melk. De tabletten niet kauwen, splitsen of breken. Slik de tabletten niet door zoals ze zijn.
Hoe lang moet EXJADE worden ingenomen?
Blijf EXJADE elke dag innemen zolang uw arts u dat zegt. Dit is een langdurige behandeling, die maanden of jaren kan duren. Uw ziekte zal regelmatig door uw arts worden gecontroleerd om te controleren of de behandeling effectief is (zie ook rubriek 2: "Controle van de behandeling met EXJADE").
Als u vragen heeft over hoe lang u EXJADE moet gebruiken, neem dan contact op met uw arts.
Bent u vergeten EXJADE in te nemen?
Als u vergeten bent een dosis in te nemen, neem deze dan in zodra u het zich herinnert gedurende die dag. Neem de volgende dosis zoals gepland. Neem de volgende dag geen dubbele dosis om de vergeten tablet(ten) in te halen.
Als u stopt met het innemen van EXJADE
Stop niet met het innemen van EXJADE tenzij uw arts u dat zegt Als u stopt met het innemen, zal het overtollige ijzer niet langer uit uw lichaam worden verwijderd (zie ook hierboven onder "Hoe lang moet u EXJADE gebruiken").
Overdosering Wat te doen als u te veel Exjade heeft ingenomen
Als u te veel EXJADE heeft ingenomen, of als iemand anders per ongeluk uw tabletten heeft ingenomen, neem dan onmiddellijk contact op met uw arts of ziekenhuis voor advies. Laat hen de verpakking met tabletten zien. Mogelijk hebt u medische behandeling nodig.
Bijwerkingen Wat zijn de bijwerkingen van Exjade
Zoals alle geneesmiddelen kan ook dit geneesmiddel bijwerkingen hebben, al krijgt niet iedereen daarmee te maken. De meeste bijwerkingen zijn licht tot matig van aard en verdwijnen gewoonlijk na een behandelingsperiode van enkele dagen tot enkele weken.
Sommige bijwerkingen kunnen ernstig zijn en vereisen onmiddellijke medische aandacht.
Deze bijwerkingen komen soms voor (komen voor bij minder dan 1 op de 100 gebruikers) of zelden (komen voor bij minder dan 1 op de 1.000 gebruikers).
- Als u ernstige huiduitslag heeft, of moeite heeft met ademhalen en duizeligheid of zwelling, voornamelijk van het gezicht en de keel (tekenen van een ernstige allergische reactie),
- Als u ernstige huiduitslag, rode huid, blaarvorming op de lippen, in de ogen of in de mond, vervellen van de huid, koorts (tekenen van een ernstige huidreactie),
- Als u een duidelijke vermindering van uw urineproductie bemerkt (teken van nierprobleem),
- Als u een combinatie ervaart van slaperigheid, pijn in de rechter bovenbuik, geel worden of meer geel worden van de huid of ogen en donkere urine (tekenen van leverproblemen),
- Als u bloed overgeeft en/of zwarte ontlasting heeft,
- Als u vaak buikpijn heeft, vooral na het eten of het innemen van EXJADE,
- Als u regelmatig last heeft van brandend maagzuur,
- Als u gedeeltelijk gezichtsverlies ervaart,
- Als u hevige pijn in de bovenbuik (pancreatitis) krijgt, stop dan met het gebruik van dit geneesmiddel en vertel het onmiddellijk aan uw arts.
Sommige bijwerkingen kunnen ernstig worden.
Deze bijwerkingen komen niet vaak voor.
- Als u wazig of wazig ziet,
- Als u een verminderd gehoor heeft,
vertel het uw arts zo snel mogelijk.
Andere bijwerkingen
Zeer vaak (kan voorkomen bij meer dan 1 op de 10 mensen)
- Veranderingen in nierfunctietesten.
Vaak (kan voorkomen bij maximaal 1 op de 10 mensen)
- Gastro-intestinale stoornissen, zoals misselijkheid, braken, diarree, buikpijn, opgeblazen gevoel, constipatie, indigestie
- Uitslag
- Hoofdpijn
- Abnormale leverfunctietesten
- jeuk
- Abnormale urinetest (eiwit in urine)
Als een van deze bijwerkingen u ernstig treft, vertel dit dan aan uw arts.
Soms (komen voor bij minder dan 1 op de 100 gebruikers)
- Duizeligheid
- Koorts
- Keelpijn
- Zwelling in de armen of benen
- Huidverkleuring
- Ongerustheid
- Slaapstoornissen
- Vermoeidheid
Als een van deze bijwerkingen ernstig optreedt, vertel dit dan aan uw arts.
Frequentie niet bekend (frequentie kan met de beschikbare gegevens niet worden bepaald).
- Een afname van het aantal cellen dat betrokken is bij de bloedstolling (trombocytopenie), in het aantal rode bloedcellen (verergering van "anemie), in het aantal witte bloedcellen (neutropenie) of in het aantal van alle soorten bloedcellen ( pancytopenie)
- Haaruitval
- Nierstenen
- Lage urineproductie
- Een scheur in de wand van de maag of darmen die pijnlijk kan zijn en misselijkheid kan veroorzaken
- Ernstige pijn in de bovenbuik (pancreatitis)
- Verhoogde zuurgraad van het bloed (metabole acidose).
Melding van bijwerkingen
Krijgt u last van bijwerkingen, neem dan contact op met uw arts of apotheker.Dit geldt ook voor mogelijke bijwerkingen die niet in deze bijsluiter staan. U kunt bijwerkingen ook rechtstreeks melden via het landelijke meldsysteem. Door bijwerkingen te melden, kunt u ons helpen meer informatie te verkrijgen over de veiligheid van dit geneesmiddel.
Vervaldatum en retentie
- Buiten het zicht en bereik van kinderen houden.
- Gebruik dit geneesmiddel niet meer na de uiterste houdbaarheidsdatum. Die is te vinden op de blisterverpakking na EXP en op de doos na EXP. De uiterste houdbaarheidsdatum verwijst naar de laatste dag van die maand.
- Bewaren in de oorspronkelijke verpakking om het geneesmiddel tegen vocht te beschermen.
- Gebruik geen verpakking die beschadigd is of tekenen van manipulatie vertoont.
- Gooi geneesmiddelen niet weg via het afvalwater of met huishoudelijk afval. Vraag uw apotheker wat u met geneesmiddelen moet doen die u niet meer gebruikt. Dit helpt het milieu te beschermen.
Andere informatie
Wat bevat EXJADE
Het werkzame bestanddeel is deferasirox.
Elke dispergeerbare tablet EXJADE 125 mg bevat 125 mg deferasirox.
Elke dispergeerbare tablet EXJADE 250 mg bevat 250 mg deferasirox.
Elke dispergeerbare tablet van EXJADE 500 mg bevat 500 mg deferasirox.
De andere stoffen in dit middel zijn lactosemonohydraat, crospovidon type A, povidon, natriumlaurylsulfaat, microkristallijne cellulose, colloïdaal watervrij siliciumdioxide en magnesiumstearaat.
Beschrijving van hoe EXJADE eruit ziet en inhoud van het pakket
EXJADE wordt geleverd in de vorm van dispergeerbare tabletten. De tabletten zijn gebroken wit, rond en plat.
- EXJADE 125 mg tabletten zijn aan de ene kant gemerkt met "J 125" en aan de andere kant met "NVR".
- EXJADE 250 mg tabletten zijn aan de ene kant gemerkt met "J 250" en aan de andere kant met "NVR".
- EXJADE 500 mg tabletten zijn aan de ene kant gemerkt met "J 500" en aan de andere kant met "NVR".
EXJADE 125 mg, 250 mg en 500 mg dispergeerbare tabletten zijn verkrijgbaar in eenheidsverpakkingen met 28, 84 of 252 dispergeerbare tabletten.
EXJADE 500 mg dispergeerbare tabletten zijn ook verkrijgbaar in multiverpakkingen met 294 (3 verpakkingen van 98) dispergeerbare tabletten.
Mogelijk worden niet alle verpakkingsgrootten of sterktes in uw land in de handel gebracht.
Bron Bijsluiter: AIFA (Italiaans Geneesmiddelenbureau). Inhoud gepubliceerd in januari 2016. De aanwezige informatie is mogelijk niet up-to-date.
Om toegang te hebben tot de meest actuele versie, is het raadzaam om de website van AIFA (Italian Medicines Agency) te bezoeken. Disclaimer en nuttige informatie.
01.0 NAAM VAN HET GENEESMIDDEL
EXJADE 125 MG DISPERGEERBARE TABLETTEN
▼ Geneesmiddel onderworpen aan aanvullende monitoring. Dit zal de snelle identificatie van nieuwe veiligheidsinformatie mogelijk maken. Beroepsbeoefenaren in de gezondheidszorg wordt verzocht alle vermoedelijke bijwerkingen te melden. Zie rubriek 4.8 voor informatie over het melden van bijwerkingen.
02.0 KWALITATIEVE EN KWANTITATIEVE SAMENSTELLING
Elke dispergeerbare tablet bevat 125 mg deferasirox.
Hulpstof:
Elke dispergeerbare tablet bevat 136 mg lactose.
Voor de volledige lijst van hulpstoffen, zie rubriek 6.1.
03.0 FARMACEUTISCHE VORM
Dispergeerbare tablet
Gebroken witte, ronde, platte tabletten met afgeschuinde rand met de inscriptie NVR aan de ene kant en J 125 aan de andere.
04.0 KLINISCHE INFORMATIE
04.1 Therapeutische indicaties
EXJADE is geïndiceerd voor de behandeling van chronische ijzerstapeling als gevolg van frequente bloedtransfusies (≥7 ml/kg/maand geconcentreerde rode bloedcellen) bij patiënten van 6 jaar en ouder met bèta-thalassemie major.
EXJADE is ook geïndiceerd voor de behandeling van chronische ijzerstapeling als gevolg van bloedtransfusies wanneer behandeling met deferoxamine gecontra-indiceerd of ontoereikend is bij de volgende patiëntengroepen:
- bij patiënten met bèta-thalassemie major met ijzerstapeling als gevolg van frequente bloedtransfusies (≥7 ml/kg/maand geconcentreerde rode bloedcellen) in de leeftijd van 2 tot 5 jaar,
- bij patiënten met bèta-thalassemie major met ijzerstapeling als gevolg van zeldzame bloedtransfusies (
- bij patiënten met andere anemie van 2 jaar en ouder.
EXJADE is ook geïndiceerd voor de behandeling van chronische ijzerstapeling die chelatietherapie vereist wanneer deferoxaminetherapie gecontra-indiceerd of ontoereikend is bij patiënten van 10 jaar en ouder met niet-transfusieafhankelijke thalassemiesyndromen.
04.2 Dosering en wijze van toediening
Behandeling met EXJADE moet worden gestart en voortgezet door artsen die ervaring hebben met de behandeling van chronische ijzerstapeling.
Dosering - ijzerstapeling door bloedtransfusies
Het wordt aanbevolen om de behandeling te starten na transfusie van ongeveer 20 eenheden (ongeveer 100 ml/kg) geconcentreerde rode bloedcellen of wanneer klinische monitoring de aanwezigheid van chronische ijzerstapeling aantoont (bijv. serumferritine > 1.000 mcg/l). Doses (in mg/kg) moeten worden berekend en afgerond op de dichtstbijzijnde hele tablet.
De doelen van ijzerchelatietherapie zijn het elimineren van de hoeveelheid ijzer die in transfusies wordt toegediend en, indien nodig, het verminderen van de bestaande ijzerbelasting.
Startdosis
De aanbevolen dagelijkse startdosering van EXJADE is 20 mg/kg lichaamsgewicht.
Een dagelijkse startdosering van 30 mg/kg kan worden overwogen voor patiënten die een verhoogd ijzergehalte in het lichaam moeten verlagen en die ook meer dan 14 ml/kg/maand geconcentreerde rode bloedcellen krijgen (ongeveer > 4 eenheden/maand voor een volwassene ).
Een dagelijkse startdosering van 10 mg/kg kan worden overwogen voor patiënten die het ijzergehalte in het lichaam niet hoeven te verlagen en die ook minder dan 7 ml/kg/maand geconcentreerde rode bloedcellen krijgen (ongeveer
Voor patiënten die al adequaat zijn behandeld met deferoxamine, kan een startdosis EXJADE worden overwogen die numeriek de helft is van de dosis deferoxamine (bijv. initiële dagelijkse dosis van 20 mg/kg/dag EXJADE). Wanneer dit resulteert in een dagelijkse dosis van minder dan 20 mg/kg lichaamsgewicht, moet de respons van de patiënt worden gecontroleerd en, als onvoldoende werkzaamheid wordt bereikt, moet een dosisverhoging worden overwogen (zie rubriek 5.1).
Dosisaanpassing
Het wordt aanbevolen om het serumferritine elke maand te controleren en de dosis EXJADE zo nodig elke 3-6 maanden aan te passen op basis van de trend in de serum-ferritinewaarden. Dosisaanpassingen kunnen worden gemaakt met intervallen tussen 5 en 10 mg/kg en moet worden aangepast aan de individuele respons en therapeutische doelen van de patiënt (handhaving of vermindering van de ijzerbelasting) Bij patiënten die niet voldoende onder controle zijn met doses van 30 mg/kg (bijv. serumferritinespiegels die aanhoudend boven 2500 mcg/l blijven en geen dalende trend vertonen in de tijd) , kunnen doses tot 40 mg/kg worden overwogen.De beschikbaarheid van gegevens over de werkzaamheid en veiligheid op de lange termijn met EXJADE gebruikt in doses hoger dan 30 mg/kg is momenteel beperkt (264 patiënten gevolgd gemiddeld 1 jaar na dosisverhoging). alleen een zeer slechte beheersing van hemosiderose wordt bereikt bij doses tot 30 mg/kg, een verdere verhoging (tot een maximum van i 40 mg/kg) kan mogelijk geen bevredigende controle bereiken en alternatieve behandelingsopties kunnen worden overwogen. Als er geen bevredigende controle wordt bereikt bij doses hoger dan 30 mg/kg, mag de behandeling met deze doses niet worden voortgezet en moeten waar mogelijk alternatieve behandelingsopties worden overwogen. Doses boven 40 mg/kg worden niet aanbevolen aangezien er slechts beperkte ervaring is met doses boven dit niveau.
Bij patiënten die worden behandeld met doses hoger dan 30 mg/kg, moeten dosisverlagingen van 5 tot 10 mg/kg worden overwogen wanneer de controle is bereikt (bijv. serumferritinespiegels die aanhoudend lager zijn dan 2500 mcg/l en die in de loop van de tijd een dalende trend vertonen) . Bij patiënten bij wie de serum-ferritinespiegel de referentiewaarde heeft bereikt (meestal tussen 500 en 1.000 mcg/l), moet worden overwogen om dosisverlagingen van 5 tot 10 mg/kg te verlagen om de serum-ferritinespiegels binnen het referentiebereik te houden. consequent onder de 500 mcg/l daalt, dient stopzetting van de behandeling te worden overwogen (zie rubriek 4.4).
Dosering - niet-transfusie-afhankelijke thalassemiesyndromen
Chelatietherapie mag alleen worden gestart als er aanwijzingen zijn voor ijzerstapeling (leverijzerconcentratie (LIC) ≥ 5 mg Fe / g / dw of serumferritine consistent> 800 mcg / l). LIC is de beste methode om ijzerstapeling te bepalen en moet overal worden gebruikt. Voorzichtigheid is geboden bij alle patiënten tijdens chelatietherapie om het risico op overchelatie te minimaliseren.
Startdosis
Bij patiënten met niet-transfusie-afhankelijke thalassemiesyndromen is de aanbevolen dagelijkse startdosering van EXJADE 10 mg/kg lichaamsgewicht.
Dosisaanpassing
Het wordt aanbevolen om het serumferritine maandelijks te controleren. Na elke 3-6 maanden behandeling moet een dosisverhoging in stappen van 5 tot 10 mg/kg worden overwogen als de LIC van de patiënt ≥7 mg Fe/g dw is, of als het serumferritine constant > 2000 mcg/l is en niet zichtbaar is. een dalende trend, en als de patiënt het medicijn goed verdraagt. Doses hoger dan 20 mg/kg worden niet aanbevolen omdat er geen ervaring is met doses boven dit niveau bij patiënten met niet-transfusie-afhankelijke thalassemiesyndromen.
Bij patiënten bij wie LIC niet is geëvalueerd en het serumferritine ≤ 2000 mcg/l is, mag de dosering niet hoger zijn dan 10 mg/kg.
Voor patiënten bij wie de dosis is verhoogd tot meer dan 10 mg/kg, wordt een dosisverlaging tot 10 mg/kg of minder aanbevolen wanneer de LIC
Stopzetting van de behandeling
De behandeling moet worden stopgezet zodra een bevredigend ijzergehalte in het lichaam (LIC
Speciale categorieën patiënten
Oudere patiënten (≥65 jaar oud)
De doseringsaanbevelingen voor oudere patiënten zijn dezelfde als hierboven beschreven. In klinische onderzoeken ondervonden oudere patiënten een hogere frequentie van bijwerkingen dan jongere patiënten (in het bijzonder diarree) en ze dienen nauwlettend te worden gecontroleerd op bijwerkingen die mogelijk een dosisaanpassing vereisen.
Pediatrische populatie
De doseringsaanbevelingen voor pediatrische patiënten van 2-17 jaar met ijzerstapeling als gevolg van bloedtransfusies zijn dezelfde als voor volwassen patiënten. Bij het berekenen van de dosis moet rekening worden gehouden met de gewichtsveranderingen van pediatrische patiënten in de loop van de tijd.
Bij kinderen met ijzerstapeling als gevolg van bloedtransfusies in de leeftijd van 2 tot 5 jaar is de blootstelling lager dan bij volwassenen (zie rubriek 5.2). Bijgevolg kunnen patiënten in deze leeftijdsgroep hogere doses nodig hebben dan vereist. hetzelfde zijn als voor volwassenen, gevolgd door individuele titratie.
Bij pediatrische patiënten met niet-transfusie-afhankelijke thalassemiesyndromen mag de dosering niet hoger zijn dan 10 mg/kg. Bij deze patiënten is een strakkere controle van LIC en serumferritine essentieel om overmatige chelatie te voorkomen: naast maandelijkse serumferritinebeoordeling, moet LIC elke drie maanden worden gecontroleerd wanneer serumferritine ≤ 800 mcg / L is.
De veiligheid en werkzaamheid van EXJADE bij zuigelingen vanaf de geboorte tot de leeftijd van 23 maanden zijn niet vastgesteld.Er zijn geen gegevens beschikbaar.
Patiënten met een verminderde nierfunctie
EXJADE is niet onderzocht bij patiënten met een nierfunctiestoornis en is gecontra-indiceerd bij patiënten met een geschatte creatinineklaring.
Patiënten met een verminderde leverfunctie
EXJADE wordt niet aanbevolen bij patiënten met een ernstige leverfunctiestoornis (Child-Pugh-klasse C). Bij patiënten met een matige leverfunctiestoornis (Child-Pugh-klasse B) moet de dosis aanzienlijk worden verlaagd en gevolgd door een progressieve verhoging tot een limiet van 50% (zie rubrieken 4.4 en 5.2), en EXJADE moet met voorzichtigheid worden gebruikt. dergelijke patiënten. De leverfunctie moet bij alle patiënten worden gecontroleerd vóór de behandeling, elke 2 weken tijdens de eerste maand en daarna elke maand (zie rubriek 4.4).
Wijze van toediening
Voor oraal gebruik.
EXJADE moet eenmaal daags op een lege maag worden ingenomen, ten minste 30 minuten voor het eten, bij voorkeur elke dag op hetzelfde tijdstip (zie rubrieken 4.5 en 5.2).
De tabletten worden opgelost door ze te mengen in een glas water of sinaasappel- of appelsap (100-200 ml), tot een fijne suspensie is verkregen. Na inname van de suspensie moeten eventuele resten opnieuw worden gesuspendeerd in een kleine hoeveelheid water of sap en worden ingeslikt. De tabletten mogen niet in hun geheel worden gekauwd of doorgeslikt (zie ook rubriek 6.2).
04.3 Contra-indicaties
Overgevoeligheid voor de werkzame stof of voor één van de in rubriek 6.1 vermelde hulpstoffen.
Combinatie met andere ijzerchelerende therapieën omdat de veiligheid van deze combinaties niet is vastgesteld (zie rubriek 4.5).
Patiënten met geschatte creatinineklaring
04.4 Bijzondere waarschuwingen en passende voorzorgen bij gebruik
Nierfunctie:
EXJADE is alleen onderzocht bij patiënten met baseline serumcreatinine in het voor de leeftijd passende normale bereik.
Tijdens klinische onderzoeken trad bij ongeveer 36% van de patiënten een stijging van > 33% van het serumcreatinine op bij ≥ 2 opeenvolgende gelegenheden, soms boven de bovengrens van het normale bereik. Deze stijging was dosisafhankelijk. Ongeveer tweederde van de patiënten die een verhoging van het serumcreatinine vertoonden, keerde het zonder dosisaanpassing terug tot niveaus onder 33% Bij de rest van de patiënten reageerde de verhoging van het serumcreatinine niet altijd op een dosisverlaging of op stopzetting van de behandeling. zijn gemeld na postmarketinggebruik van EXJADE (zie rubriek 4.8). In sommige van deze postmarketinggevallen leidde een verslechtering van de nierfunctie tot nierfalen waardoor tijdelijke of permanente dialyse nodig was.
De oorzaken van de stijging van het serumcreatinine zijn niet opgehelderd.Daarom moet bijzondere aandacht worden besteed aan het controleren van het serumcreatinine bij patiënten die gelijktijdig geneesmiddelen gebruiken die de nierfunctie onderdrukken, en bij patiënten die hoge doses EXJADE krijgen en/of een lage frequentie van bloedtransfusies (
Het wordt aanbevolen om het serumcreatinine tweemaal te beoordelen voordat de behandeling wordt gestart. Serumcreatinine, creatinineklaring (geschat met Cockcroft-Gault-formule of MDRD bij volwassenen en Schwartz-formule bij kinderen) en/of plasmacystatine C-spiegels moeten wekelijks worden gecontroleerd gedurende de eerste maand na het starten of wijzigen van de therapie met EXJADE, en eenmaal per maand Patiënten met eerdere nieraandoeningen en patiënten die geneesmiddelen gebruiken die de nierfunctie onderdrukken, lopen mogelijk een verhoogd risico op complicaties. Bij patiënten die diarree of braken hebben, moet voor voldoende hydratatie worden gezorgd.
Er zijn gevallen van metabole acidose gemeld tijdens postmarketingbehandeling met EXJADE. De meerderheid van deze patiënten had nierinsufficiëntie, niertubulopathie (Fanconi-syndroom) of diarree, of aandoeningen waarbij een zuur-base-onbalans een bekende complicatie is. Bij deze populaties moet het zuur-base-evenwicht worden gecontroleerd zoals klinisch geïndiceerd. Stopzetting van EXJADE-transplantatie moet worden overwogen bij patiënten die metabole acidose ontwikkelen.
Voor volwassen patiënten kan de dagelijkse dosis worden verlaagd met 10 mg/kg als bij twee opeenvolgende bezoeken een stijging van het serumcreatinine van> 33% boven het gemiddelde van de waarden van vóór de behandeling en een afname van de klaring wordt waargenomen. de ondergrens van het normale bereik (
Als bij volwassen en pediatrische patiënten na dosisverlaging een stijging van het serumcreatinine> 33% boven het gemiddelde van de waarden van voor de behandeling wordt waargenomen en/of de berekende creatinineklaring onder de ondergrens van het "normale bereik" daalt, moet de behandeling Afhankelijk van de individuele klinische omstandigheden kan de behandeling worden hervat.
Proteïnurietests moeten maandelijks worden uitgevoerd. Indien nodig kunnen ook andere markers van de niertubulaire functie worden gecontroleerd (bijv. glycosurie bij niet-diabetische patiënten en lage serumspiegels van kalium, fosfaat, magnesium of uraat, fosfaturie, aminoacidurie). Dosisverlaging of stopzetting van de behandeling kan worden overwogen als er afwijkingen zijn in de markerniveaus van de tubulaire functie en/of indien klinisch geïndiceerd Niertubulopathie is voornamelijk gemeld bij kinderen en adolescenten met bèta-thalassemie die werden behandeld met EXJADE.
Als, ondanks dosisverlaging of stopzetting van de behandeling, het serumcreatinine significant verhoogd blijft en als er ook een aanhoudende afwijking is in een andere marker van de nierfunctie (bijv. proteïnurie, Fanconi-syndroom), moet de patiënt worden doorverwezen naar een nefroloog en aanvullende specialistische tests (zoals een nierbiopsie) kan worden overwogen.
Lever functie:
Verhoogde leverfunctietesten zijn waargenomen bij patiënten die met EXJADE werden behandeld. Postmarketinggevallen van leverfalen, waarvan sommige met fatale afloop, zijn gemeld bij patiënten die met EXJADE werden behandeld. De meeste gevallen van leverfalen betroffen patiënten met significante morbiditeit, waaronder reeds bestaande levercirrose. De rol van EXJADE als een bijdragende of verzwarende factor kan echter niet worden uitgesloten (zie rubriek 4.8).
Het wordt aanbevolen om de serumtransaminasen, bilirubine en alkalische fosfatase vóór aanvang van de behandeling te controleren, elke 2 weken gedurende de eerste maand en daarna maandelijks.Als er een aanhoudende en progressieve verhoging van de serumtransaminasespiegels is die niet aan andere oorzaken kan worden toegeschreven, dient EXJADE Zodra de oorzaak van de afwijkingen in de leverfunctietest is opgehelderd of na terugkeer naar normale niveaus, kan een voorzichtige hervatting van de behandeling met een lagere dosis worden overwogen, gevolgd door een geleidelijke verhoging van de dosis.
EXJADE wordt niet aanbevolen bij patiënten met een ernstige leverfunctiestoornis (Child-Pugh-klasse C) (zie rubriek 5.2).
Samenvatting van de aanbevelingen voor veiligheidsmonitoring:
Bij patiënten met een korte levensverwachting (bijv. myolodysplastische syndromen met een hoog risico), vooral wanneer gelijktijdige morbiditeit het risico op bijwerkingen kan verhogen, kan het voordeel van EXJADE beperkt zijn en kleiner zijn dan de risico's. Daarom wordt behandeling met EXJADE bij deze patiënten niet aanbevolen.
Voorzichtigheid is geboden bij oudere patiënten vanwege een hogere frequentie van bijwerkingen (in het bijzonder diarree).
Gegevens over kinderen met niet-transfusieafhankelijke thalassemie zijn zeer beperkt (zie rubriek 5.1). Daarom moet bij pediatrische patiënten de behandeling met EXJADE zeer nauwlettend worden gecontroleerd op bijwerkingen en de ijzerstapeling. Bovendien dienen artsen, alvorens kinderen met niet-transfusieafhankelijke thalassemie en overmatige ijzerstapeling met EXJADE te behandelen, zich ervan bewust te zijn dat de gevolgen van langdurige blootstelling bij deze patiënten op dit moment niet bekend zijn.
Maagdarmstelselaandoeningen
Zweren en bloedingen van het bovenste deel van het maagdarmkanaal zijn gemeld bij patiënten die EXJADE kregen, inclusief kinderen en adolescenten. Bij sommige patiënten zijn meerdere ulcera waargenomen (zie rubriek 4.8). Er zijn meldingen geweest van gecompliceerde zweren met perforatie van het spijsverteringsstelsel Er zijn ook meldingen van fatale gastro-intestinale bloedingen, vooral bij oudere patiënten met hematologische maligniteiten en/of een laag aantal bloedplaatjes Artsen en patiënten dienen te worden geadviseerd tijdens de behandeling met EXJADE. let op het begin van tekenen en symptomen van gastro-intestinale ulceratie en bloeding en start onmiddellijk evaluatie en gelijktijdige behandeling als een ernstige gastro-intestinale bijwerking wordt vermoed. Voorzichtigheid is geboden bij patiënten die EXJADE gebruiken in combinatie met stoffen met een erkend ulcerogeen potentieel, zoals niet-steroïde anti-inflammatoire geneesmiddelen, corticosteroïden of orale bisfosfonaten, bij patiënten die anticoagulantia gebruiken en bij patiënten met een aantal bloedplaatjes lager dan 50.000 / mm3 (50 x 109 / l) (zie rubriek 4.5).
Huidaandoeningen
Tijdens de behandeling met EXJADE kan huiduitslag optreden. In de meeste gevallen verdwijnen de uitslag spontaan. Als onderbreking van de behandeling noodzakelijk is, kan de behandeling worden hervat nadat de uitbarsting is verdwenen, met een lagere dosis die vervolgens geleidelijk kan worden verhoogd. In ernstige gevallen kan de behandeling voor een korte tijd worden hervat in combinatie met orale steroïden. Postmarketing zijn gevallen van Stevens-Johnson-syndroom (SJS) gemeld. Het risico op andere, meer ernstige huidreacties [toxische epidermale necrolyse (TEN), geneesmiddelreactie met eosinofilie en systemische symptomen (DRESS)] kan niet worden uitgesloten. Als SJS of een andere ernstige huidreactie wordt vermoed, moet EXJADE onmiddellijk worden stopgezet en mag niet opnieuw worden geïntroduceerd.
Overgevoeligheidsreacties
Gevallen van ernstige overgevoeligheidsreacties (zoals anafylaxie en angio-oedeem) zijn gemeld bij patiënten die EXJADE kregen, waarbij de reactie in de meeste gevallen binnen de eerste maand van de behandeling optrad (zie rubriek 4.8). Als dergelijke reacties optreden, moet EXJADE worden gestaakt en moet een passende medische interventie worden ingesteld. Vanwege het risico op anafylactische shock mag deferasirox niet opnieuw worden geïntroduceerd bij patiënten die een overgevoeligheidsreactie hebben gehad (zie rubriek 4.3).
Zicht en gehoor
Er zijn auditieve (gehoorverlies) en oculaire (lenstroebelheid) stoornissen gemeld (zie rubriek 4.8.) Het wordt aanbevolen om auditieve en oftalmische onderzoeken (inclusief fundoscopie) uit te voeren vóór aanvang van de behandeling en daarna met regelmatige tussenpozen (elke 12 maanden). . Als tijdens de behandeling stoornissen worden opgemerkt, kan een dosisverlaging of stopzetting van de behandeling worden overwogen.
Bloedziekte
Bij patiënten die met EXJADE werden behandeld, zijn post-marketing gevallen van leukopenie, trombocytopenie of pancytopenie (of verergering van deze cytopenieën) en verergering van anemie gemeld. De meeste van deze patiënten hadden reeds bestaande hematologische stoornissen die vaak gepaard gaan met insufficiëntie. een bijdragende of verzwarende rol van de behandeling kan niet worden uitgesloten Stopzetting van de behandeling moet worden overwogen bij patiënten die cytopenie ontwikkelen die aan geen enkele oorzaak kan worden toegeschreven.
Andere Overwegingen
Het wordt aanbevolen om de serum-ferritinespiegels maandelijks te controleren om de respons van de patiënt op de therapie te beoordelen (zie rubriek 4.2). Als serumferritine consequent onder 500 mcg/l daalt (bij ijzerstapeling door bloedtransfusies) of onder 300 mcg/l (bij niet-transfusie-afhankelijke thalassemiesyndromen), moet de mogelijkheid van "stopzetting van de behandeling" worden overwogen.
Resultaten van serumcreatinine-, serumferritine- en serumtransaminasetests moeten regelmatig worden geregistreerd en geëvalueerd om de voortgang ervan te controleren.De resultaten moeten ook worden gerapporteerd in het aan de patiënt verstrekte notitieboek.
In een klinische studie had een behandeling met EXJADE gedurende maximaal 5 jaar geen invloed op de groei en seksuele ontwikkeling van behandelde pediatrische patiënten. Als algemene voorzorgsmaatregel voor de behandeling van pediatrische patiënten met ijzerstapeling als gevolg van bloedtransfusies, moeten lichaamsgewicht, groei en seksuele ontwikkeling echter met regelmatige tussenpozen (elke 12 maanden) worden gecontroleerd.
Hartdisfunctie is een bekende complicatie van ernstige ijzerstapeling. Bij patiënten met ernstige ijzerstapeling moet de hartfunctie worden gecontroleerd tijdens langdurige behandeling met EXJADE.
Elke tablet bevat 136 mg lactose. Patiënten met zeldzame erfelijke aandoeningen als galactose-intolerantie, Lapp-lactasedeficiëntie, glucose-galactosemalabsorptie of ernstige lactasedeficiëntie dienen dit geneesmiddel niet te gebruiken.
04.5 Interacties met andere geneesmiddelen en andere vormen van interactie
De veiligheid van EXJADE in combinatie met andere ijzerchelatoren is niet vastgesteld. Daarom mag het niet worden gecombineerd met andere ijzerchelerende therapieën (zie rubriek 4.3).
Gelijktijdige toediening van EXJADE met stoffen die een erkend ulcerogeen potentieel hebben, zoals niet-steroïde anti-inflammatoire geneesmiddelen (waaronder hoge doses acetylsalicylzuur), orale corticosteroïden of bisfosfonaten kan het risico op gastro-intestinale toxiciteit verhogen (zie rubriek 4.4). EXJADE met anticoagulantia kan ook het risico op gastro-intestinale bloedingen verhogen. Nauwgezette klinische controle is vereist wanneer deferasirox wordt gecombineerd met deze stoffen.
De biologische beschikbaarheid van deferasirox was variabel verhoogd bij gelijktijdig gebruik met voedsel.EXJADE dient daarom op een lege maag te worden ingenomen, ten minste 30 minuten voor het eten, bij voorkeur elke dag op hetzelfde tijdstip (zie rubrieken 4.2 en 5.2. ).
Deferasirox wordt gemetaboliseerd door UGT-enzymen. In een onderzoek bij gezonde vrijwilligers resulteerde de gelijktijdige toediening van EXJADE (eenmalige dosis van 30 mg/kg) en de krachtige UGT-enzyminductor rifampicine (herhaalde dosis van 600 mg/dag) in een afname van de blootstelling aan deferasirox. 90%-BI: 37% - 51%). Daarom kan gelijktijdig gebruik van EXJADE met krachtige UGT-enzyminductoren (bijv. rifampicine, carbamazepine, fenytoïne, fenobarbital, ritonavir) leiden tot verminderde werkzaamheid van EXJADE Het serumferritine van de patiënt moet tijdens en na gelijktijdige behandeling worden gecontroleerd en, indien nodig, worden aangepast de dosis EXJADE.
In een mechanistische studie om de mate van enterohepatische recirculatie te bepalen, verminderde colestyramine de blootstelling aan deferasirox significant (zie rubriek 5.2).
In een onderzoek bij gezonde vrijwilligers resulteerde de gelijktijdige toediening van EXJADE en midazolam (een substraat van cytochroom CYP3A4) in een afname van de blootstelling aan midazolam met 17% (90% BI: 8% - 26%). In de klinische praktijk kan dit effect daarom optreden. voorzichtigheid is geboden wanneer deferasirox wordt gecombineerd met geneesmiddelen die via CYP3A4 worden gemetaboliseerd (bijv. ciclosporine, simvastatine, hormonale anticonceptiva, bepridil, ergotamine), gezien de mogelijke vermindering van hun werkzaamheid.
In een onderzoek bij gezonde vrijwilligers verhoogde de gelijktijdige toediening van deferasirox als een matige remmer van CYP2C8 (30 mg/kg/dag) met CYP2C8-substraat repaglinide, gegeven als een enkelvoudige dosis van 0,5 mg, de AUC en Cmax van repaglinide ongeveer 2,3 keer ( 90% BI [2,03-2,63]) respectievelijk 1,6 keer (90% BI [1,42-1,84]) van repaglinide hoger dan 0,5 mg is niet vastgesteld, gelijktijdig gebruik van deferasirox met repaglinide dient te worden vermeden. glucosemonitoring dient te worden uitgevoerd als de combinatie noodzakelijk blijkt (zie rubriek 4.4). Een interactie tussen deferasirox en andere CYP2C8-substraten zoals paclitaxel kan niet worden uitgesloten.
In een onderzoek bij gezonde vrijwilligers resulteerde de gelijktijdige toediening van EXJADE als CYP1A2-remmer (herhaalde dosis van 30 mg/kg/dag) en CYP1A2-substraattheofylline (enkele dosis van 120 mg) in een verhoging van de AUC. 84% theofylline (90 %-BI: 73% -95%). De Cmax van een enkele dosis werd niet beïnvloed, maar bij chronische toediening wordt een verhoging van de Cmax van theofylline verwacht. Daarom wordt gelijktijdig gebruik van EXJADE en theofylline niet aanbevolen. Als EXJADE en theofylline gelijktijdig worden gebruikt, moet controle van de theofyllineconcentratie en een verlaging van de theofyllinedosis worden overwogen. Een interactie tussen EXJADE en andere CYP1A2-substraten mag niet worden overwogen. uitgesloten. Dezelfde aanbevelingen met betrekking tot theofylline zijn van toepassing op stoffen die voornamelijk worden gemetaboliseerd door cytochroom CYP1A2 en die een smalle therapeutische index hebben (bijv. clozapine, tizanidine).
De gelijktijdige toediening van EXJADE en aluminiumbevattende antacidumpreparaten is niet formeel onderzocht. Hoewel deferasirox een lagere affiniteit heeft voor aluminium dan voor ijzer, wordt het niet aanbevolen om EXJADE-tabletten in te nemen met aluminiumbevattende antacidumpreparaten.
De gelijktijdige toediening van EXJADE en vitamine C is niet formeel onderzocht. Vitamine C-doses tot 200 mg per dag zijn niet in verband gebracht met nadelige gevolgen.
Er werd geen interactie waargenomen tussen EXJADE en digoxine bij gezonde volwassen vrijwilligers.
04.6 Zwangerschap en borstvoeding
Zwangerschap
Voor deferasirox zijn geen klinische gegevens beschikbaar over blootgestelde zwangerschappen. Dierstudies hebben reproductietoxiciteit aangetoond bij doseringen die toxisch zijn voor het moederdier (zie rubriek 5.3). Het potentiële risico voor mensen is niet bekend.
Uit voorzorg wordt aangeraden EXJADE niet te gebruiken tijdens de zwangerschap, tenzij dit absoluut noodzakelijk is.
EXJADE kan de werkzaamheid van hormonale anticonceptiva verminderen (zie rubriek 4.5).
Voedertijd
In dierstudies bleek deferasirox snel en uitgebreid in de moedermelk te worden uitgescheiden. Er werden geen effecten op nakomelingen waargenomen. Het is niet bekend of deferasirox wordt uitgescheiden in de moedermelk. Borstvoeding wordt niet aanbevolen tijdens het gebruik van EXJADE.
Vruchtbaarheid
Er zijn geen vruchtbaarheidsgegevens beschikbaar voor mensen Bij dieren werden geen nadelige effecten op de mannelijke of vrouwelijke vruchtbaarheid gevonden (zie rubriek 5.3).
04.7 Beïnvloeding van de rijvaardigheid en het vermogen om machines te bedienen
Er is geen onderzoek gedaan naar de effecten van EXJADE op de rijvaardigheid en op het vermogen om machines te bedienen.Patiënten die duizeligheid ervaren, een bijwerking die soms voorkomt, dienen voorzichtig te zijn bij het besturen van een voertuig of het bedienen van machines (zie paragraaf 4.8).
04.8 Bijwerkingen
Samenvatting van het veiligheidsprofiel
De meest frequent gemelde reacties tijdens chronische behandeling met EXJADE bij volwassen en pediatrische patiënten omvatten maagdarmstoornissen bij ongeveer 26% van de patiënten (voornamelijk misselijkheid, braken, diarree of buikpijn) en huiduitslag bij ongeveer 7% van de patiënten. Diarree werd het vaakst gemeld bij pediatrische patiënten van 2 tot 5 jaar en bij ouderen. Deze reacties zijn dosisafhankelijk, meestal licht tot matig van intensiteit, meestal van voorbijgaande aard en verdwijnen in de meeste gevallen zelfs bij voortzetting van de behandeling.
Tijdens klinische onderzoeken ervoer ongeveer 36% van de patiënten verhogingen van het serumcreatinine > 33% in twee of meer opeenvolgende bepalingen, soms boven de bovengrens van het normale bereik. Ze waren dosisafhankelijk. Ongeveer tweederde van de patiënten die een verhoging ervoeren in serumcreatinine keerde terug tot onder 33% zonder dosisaanpassing Bij de overige patiënten reageerde de verhoging van serumcreatinine niet altijd op dosisverlaging of stopzetting van de behandeling In sommige gevallen werd na dosisverlaging inderdaad alleen stabilisatie van serumcreatininewaarden waargenomen (zie rubriek 4.4).
In een retrospectieve meta-analyse van 2.102 volwassen en pediatrische bèta-thalassemiepatiënten met transfusie-ijzerstapeling (inclusief patiënten met verschillende kenmerken zoals transfusie-intensiteit, dosis en duur van de behandeling) die werden behandeld in twee gerandomiseerde klinische onderzoeken en vier open-label onderzoeken naar tot vijf jaar werd een afname van de gemiddelde creatinineklaring van 13,2% waargenomen bij volwassen patiënten (95% BI: -14,4%, -12,1%; n = 935) en 9, 9% bij pediatrische patiënten (95% BI: - 11,1%, -8,6%; n = 1142) tijdens het eerste jaar van de behandeling. Bij een subgroep van patiënten die langer dan een jaar werden gevolgd (n = 250 tot vijf jaar) werd in de daaropvolgende jaren geen verdere daling van de gemiddelde creatinineklaring waargenomen.
In een gerandomiseerde, dubbelblinde, placebogecontroleerde, eenjarige studie bij patiënten met niet-transfusie-afhankelijke thalassemiesyndromen en ijzerstapeling, werden de meest frequente geneesmiddelgerelateerde bijwerkingen gemeld door patiënten behandeld met EXJADE 10 mg/kg/ dag waren diarree (9,1%), huiduitslag (9,1%) en misselijkheid (7,3%). Veranderingen in serumcreatinine en creatinineklaring werden gemeld bij respectievelijk 5,5% en 1,8% van de patiënten die werden behandeld met EXJADE 10 mg/kg/dag.Verhogingen van levertransaminase groter dan 2 keer de uitgangswaarde en 5 keer de bovengrens van normaal werden gemeld bij 1,8% van de patiënten behandeld met EXJADE 10 mg/kg/dag.
Tabel met bijwerkingen
Bijwerkingen zijn hieronder gerangschikt volgens de volgende conventie: zeer vaak (≥1/10); gemeenschappelijk (≥1 / 100,
tafel 1
1 Bijwerkingen gemeld tijdens postmarketingervaring Ze komen voort uit spontane meldingen waarvan het niet altijd mogelijk is om de frequentie of een causaal verband met blootstelling aan het geneesmiddel vast te stellen.
Galstenen en gerelateerde galaandoeningen zijn gemeld bij ongeveer 2% van de patiënten. Verhoging van transaminasen werd gemeld als bijwerking bij 2% van de patiënten. Een verhoging van de transaminasen met meer dan 10 maal de bovengrens van het normale bereik, indicatief voor hepatitis, kwam soms (0,3%) voor (0,3%). In postmarketingervaring is leverfalen, soms fataal, gemeld met EXJADE, vooral bij patiënten met reeds bestaande levercirrose (zie rubriek 4.4).Post-marketing gevallen van metabole acidose zijn gemeld. De meerderheid van deze patiënten had een nierfunctiestoornis, niertubulopathie (Fanconi-syndroom) of diarree, of aandoeningen waarbij een zuur-base-onbalans een bekende complicatie is (zie rubriek 4.4). Ernstige acute pancreatitis kan zich voordoen als een complicatie van galstenen (en gerelateerde galaandoeningen). Net als bij andere ijzerchelerende behandelingen, werden soms hoogfrequent gehoorverlies en troebeling van de lens (vroege cataract) waargenomen bij patiënten die werden behandeld met EXJADE (zie rubriek 4.4).
Pediatrische populatie
Diarree werd vaker gemeld bij pediatrische patiënten van 2 tot 5 jaar dan bij oudere patiënten.
Niertubulopathie is voornamelijk gemeld bij kinderen en adolescenten met bètathalassemie die werden behandeld met EXJADE.
Melding van vermoedelijke bijwerkingen
Het melden van vermoedelijke bijwerkingen die optreden na toelating van het geneesmiddel is belangrijk omdat het een continue controle van de baten/risicoverhouding van het geneesmiddel mogelijk maakt. Beroepsbeoefenaren in de gezondheidszorg wordt verzocht alle vermoedelijke bijwerkingen te melden via het nationale meldsysteem. in "Bijlage V .
04.9 Overdosering
Gevallen van overdosering (2-3 maal de voorgeschreven dosis gedurende meerdere weken) zijn gemeld. In één geval leidde dit tot subklinische hepatitis die verdween na een "stopzetting van de behandeling". Enkelvoudige doses van 80 mg/kg bij patiënten met ijzerstapeling veroorzaakten lichte misselijkheid en diarree.
Acute tekenen van overdosering kunnen misselijkheid, braken, hoofdpijn en diarree zijn. Overdosering kan worden behandeld door inductie van braken of maagspoeling en met symptomatische behandeling.
05.0 FARMACOLOGISCHE EIGENSCHAPPEN
05.1 Farmacodynamische eigenschappen
Farmacotherapeutische categorie: ijzerchelaatvormer.
ATC-code: V03AC03.
Werkingsmechanisme
Deferasirox is een oraal actieve chelator, zeer selectief voor ijzer (III). Het is een drietandige ligand die ijzer bindt met een hoge affiniteit in een verhouding van 2:1. Deferasirox bevordert de uitscheiding van ijzer, voornamelijk in de feces.Deferasirox heeft een lage affiniteit voor zink en koper en veroorzaakt geen gestage daling van de serumspiegels van deze metalen.
Farmacodynamische effecten
In een ijzerbalans metabolisch onderzoek bij volwassen thalassemiepatiënten met ijzerstapeling, induceerde EXJADE bij dagelijkse doses van 10, 20 en 40 mg/kg een gemiddelde netto-excretie van respectievelijk 0,119, 0,329 en 0,445 mg Fe/kg lichaamsgewicht/dag.
Klinische werkzaamheid en veiligheid
EXJADE is onderzocht bij 411 volwassen patiënten (leeftijd ≥ 16 jaar) en 292 pediatrische patiënten (leeftijd 2 tot sikkelcelanemie en andere aangeboren en verworven anemieën (myelodysplastische syndromen, Diamond-Blackfan-syndroom, aplastische anemie en andere zeer zeldzame anemieën).
Dagelijkse behandeling van frequent getransfundeerde volwassen en pediatrische patiënten met bèta-thalassemie in doses van 20 en 30 mg / kg gedurende één jaar leidde tot een verlaging van de totale ijzerindicatoren voor het lichaam; de ijzerconcentratie in de lever was gemiddeld met ongeveer -0,4 en -8,9 mg Fe/g lever (drooggewicht uit biopsie) verlaagd en het serum-ferritine was gemiddeld met ongeveer -36 en -926 mcg/l verlaagd. Bij dezelfde doses waren de verhoudingen van ijzeruitscheiding tot ijzerinname respectievelijk 1,02 (wat wijst op een netto ijzerbalans) en 1,67 (wat wijst op een "netto ijzereliminatie"). EXJADE induceerde vergelijkbare reacties bij patiënten met ijzerstapeling die werden beïnvloed door andere anemieën. Dagelijkse doses van 10 mg/kg gedurende één jaar kan de ijzer- en serumferritinespiegels in de lever handhaven en een netto ijzerbalans induceren bij patiënten die niet-frequente transfusies of erythrocyto-aferese krijgen. gebruikt om de respons op de therapie te controleren. De beperkte klinische gegevens (29 patiënten met een normale hartfunctie bij aanvang) bij het gebruik van MRI wijzen erop dat behandeling met EXJADE 10-30 mg/kg/dag gedurende 1 jaar ook het ijzergehalte in het hart kan verlagen (gemiddeld is de toename van MRI T2 * was van 18,3 tot 23,0 milliseconden).
De hoofdanalyse van het centrale vergelijkende onderzoek uitgevoerd bij 586 patiënten met bèta-thalassemie en ijzerstapeling als gevolg van bloedtransfusies toonde niet de non-inferioriteit van EXJADE aan deferoxamine aan in de analyse van de totale patiëntenpopulatie. Een post-hoc analyse van deze studie toont aan dat in de subgroep van patiënten met een ijzerconcentratie in de lever ≥7 mg Fe/g drooggewicht behandeld met EXJADE (20 en 30 mg/kg) of deferoxamine (35 tot ≥50 mg/kg), aan de non-inferioriteitscriteria is voldaan. Bij patiënten met een ijzerconcentratie in de lever
Preklinische en klinische onderzoeken hebben aangetoond dat EXJADE actief kan zijn als deferoxamine bij gebruik in een dosisverhouding van 2:1 (bijv. een dosis EXJADE is numeriek de helft van de dosis deferoxamine). Deze doseringsaanbeveling is echter niet prospectief geëvalueerd in klinische onderzoeken.
Bovendien veroorzaakt EXJADE tot 20 en 30 mg/kg bij patiënten met een ijzerconcentratie in de lever ≥7 mg Fe/g droog gewicht die lijden aan verschillende zeldzame anemieën of sikkelcelanemie, een verlaging van de ijzer- en serumferritineconcentraties in de lever die vergelijkbaar is met de verkregen bij patiënten met bèta-thalassemie.
Bij patiënten met niet-transfusie-afhankelijke thalassemiesyndromen en ijzerstapeling werd de behandeling met EXJADE geëvalueerd in een eenjarig, gerandomiseerd, dubbelblind, placebogecontroleerd onderzoek. De studie vergeleek de werkzaamheid van twee verschillende deferasirox-regimes (startdoses van 5 en 10 mg/kg/dag, 55 patiënten in elke arm) en de corresponderende placebo (56 patiënten). 145 volwassen patiënten en 21 pediatrische patiënten. De primaire werkzaamheidsparameter was de verandering in de ijzerconcentratie in de lever (LIC) vanaf baseline na 12 maanden behandeling Een van de secundaire werkzaamheidsparameters was de verandering in serumferritine tussen baseline en vierde trimester startdosis van 10 mg/kg/dag, EXJADE leidde tot een verlaging in indicatoren van het totale ijzergehalte in het lichaam Gemiddeld nam de ijzerconcentratie in de lever af met 3,80 mg Fe / g droog gewicht bij patiënten die werden behandeld met EXJADE (begindosis van 10 mg / kg / dag) en steeg met 0,38 mg Fe / g / droog gewicht in patiënten behandeld met placebo (p
Het Europees Geneesmiddelenbureau heeft besloten tot uitstel van de verplichting voor de fabrikant om de resultaten in te dienen van onderzoek met EXJADE in een of meerdere subgroepen van pediatrische patiënten voor de behandeling van chronische ijzerstapeling waarvoor chelatietherapie vereist is (zie rubriek 4.2 voor informatie over pediatrisch gebruik).
05.2 Farmacokinetische eigenschappen
Absorptie
Deferasirox wordt geabsorbeerd na orale toediening met een mediane tijd tot maximale plasmaconcentratie (Tmax) van ongeveer 1,5 tot 4 uur. De absolute biologische beschikbaarheid (AUC) van deferasirox uit EXJADE-tabletten is ongeveer 70% in vergelijking met een intraveneuze dosis. De totale blootstelling (AUC) was ongeveer verdubbeld wanneer het werd ingenomen met een vetrijke maaltijd (vetgehalte> 50% van de calorieën) en nam toe met ongeveer 50% wanneer het werd ingenomen met een standaardmaaltijd. De biologische beschikbaarheid (AUC) deferasirox was matig (ongeveer 13-25 %) hoger wanneer het 30 minuten voor de maaltijd wordt ingenomen met een normaal of hoog vetgehalte.
Verdeling
Deferasirox is sterk (99%) gebonden aan plasma-eiwitten, bijna uitsluitend aan serumalbumine, en heeft een klein distributievolume van ongeveer 14 liter bij volwassenen.
Biotransformatie
Glucuronidering is de belangrijkste metabole route voor deferasirox, met daaropvolgende uitscheiding via de gal. Deconjugatie van glucuroniden in de darm en daaropvolgende reabsorptie (enterohepatische recirculatie) is waarschijnlijk: In een onderzoek bij gezonde vrijwilligers resulteerde toediening van colestyramine na een enkelvoudige dosis deferasirox in een afname van 45% van de blootstelling aan deferasirox (AUC).
Deferasirox wordt voornamelijk geglucuronideerd via UGT1A1 en in mindere mate UGT1A3. Het door CYP450 gekatalyseerde (oxidatieve) metabolisme van deferasirox lijkt bij mensen gering (ongeveer 8%). In vitro er werd geen remming van het deferasirox-metabolisme door hydroxyureum waargenomen.
Eliminatie
Deferasirox en zijn metabolieten worden voornamelijk uitgescheiden in de feces (84% van de dosis). De renale excretie van deferasirox en zijn metabolieten is minimaal (8% van de dosis) De gemiddelde eliminatiehalfwaardetijd (t1/2) varieert van 8 tot 16 uur. MRP2- en MXR-transporters (BCRP) zijn betrokken bij de galuitscheiding van deferasirox.
Lineariteit / Niet-lineariteit
Onder steady-state-omstandigheden nemen de Cmax en AUC0-24h van deferasirox ongeveer lineair toe met de dosis.Bij meervoudige dosering neemt de blootstelling toe met een accumulatiefactor van 1,3 tot 2,3.
Kenmerken van patiënten
Pediatrische patiënten
De totale blootstelling van adolescenten (12 tot ≤17 jaar) en kinderen (2 tot
Seks
Vrouwen hebben een matig lagere (17,5%) schijnbare klaring van deferasirox dan mannen. Aangezien de dosering op individuele basis wordt aangepast aan de respons, zal dit naar verwachting geen klinische gevolgen hebben.
Oudere patiënten
De farmacokinetiek van deferasirox is niet onderzocht bij oudere patiënten (van 65 jaar en ouder).
Nier- of leverinsufficiëntie
De farmacokinetiek van deferasirox is niet onderzocht bij patiënten met nierinsufficiëntie. De farmacokinetiek van deferasirox wordt niet beïnvloed door levertransaminasespiegels tot 5 keer de bovengrens van het normale bereik.
In een klinisch onderzoek met enkelvoudige doses van 20 mg/kg deferasirox nam de gemiddelde blootstelling toe met 16% bij proefpersonen met een lichte leverfunctiestoornis (Child-Pugh-klasse A) en met 76% bij proefpersonen met een matige leverfunctiestoornis (Child-Pugh-klasse). B) vergeleken met proefpersonen met een normale leverfunctie Bij proefpersonen met een lichte tot matige leverfunctiestoornis nam de gemiddelde Cmax van deferasirox toe met 22% Bij proefpersonen met een ernstige leverfunctiestoornis (Child-Pugh-klasse C) nam de blootstelling 2,8-voudig toe (zie rubrieken 4.2 en 4.4).
05.3 Gegevens uit het preklinisch veiligheidsonderzoek
Niet-klinische gegevens duiden niet op een speciaal risico voor patiënten met ijzerstapeling, gebaseerd op conventionele onderzoeken van veiligheidsfarmacologie, toxiciteit bij herhaalde dosering, genotoxiciteit of carcinogeen potentieel. De belangrijkste bevindingen waren niertoxiciteit en lenstroebelheid (cataract). Vergelijkbaar bewijs werd gezien bij pasgeboren en juveniele dieren. Aangenomen wordt dat niertoxiciteit voornamelijk te wijten is aan ijzerverlies bij dieren die niet eerder een ijzerstapeling hadden.
Genotoxiciteitstesten in vitro waren negatief (Ames-test, chromosomale aberratietest) of positief (screen V79). Deferasirox veroorzaakte de vorming van micronuclei in vivo in het beenmerg, maar niet in de lever, bij ratten die geen dodelijke dosis ijzer kregen toegediend.Dergelijke effecten werden niet waargenomen bij ratten die geen ijzerlading kregen. Deferasirox was niet carcinogeen bij toediening aan ratten in een 2 jaar durende studie en p53 +/- transgene heterozygote muizen in een 6 maanden durende studie.
Het potentieel voor reproductietoxiciteit werd geëvalueerd bij ratten en konijnen. Deferasirox was niet teratogeen, maar veroorzaakte een verhoogde frequentie van skeletveranderingen en doodgeboorten bij ratten bij hoge doses die ernstig toxisch waren voor de moeder zonder ijzerstapeling. Deferasirox veroorzaakte geen andere effecten op de vruchtbaarheid of de voortplanting.
06.0 FARMACEUTISCHE INFORMATIE
06.1 Hulpstoffen
Lactosemonohydraat
Crospovidon type A
Microkristallijne cellulose
Povidon
Natriumlaurylsulfaat
Watervrij colloïdaal silica
Magnesium stearaat
06.2 Incompatibiliteit
Dispersie in koolzuurhoudende dranken of melk wordt niet aanbevolen vanwege respectievelijk schuimvorming en langzame dispersie. De tabletten mogen niet in hun geheel worden gekauwd of doorgeslikt.
06.3 Geldigheidsduur
3 jaar.
06.4 Speciale voorzorgsmaatregelen bij bewaren
Bewaren in de oorspronkelijke verpakking om het geneesmiddel tegen vocht te beschermen.
06.5 Aard van de primaire verpakking en inhoud van de verpakking
PVC / PE / PVDC / Aluminium blisterverpakkingen.
Verpakkingen met 28, 84 of 252 dispergeerbare tabletten.
Mogelijk worden niet alle verpakkingsgrootten in de handel gebracht.
06.6 Instructies voor gebruik en verwerking
Geen speciale instructies.
07.0 HOUDER VAN DE VERGUNNING VOOR HET IN DE HANDEL BRENGEN
Novartis Europharm Limited
Frimley Business Park
Camberley GU16 7SR
VK
08.0 NUMMER VAN DE VERGUNNING VOOR HET IN DE HANDEL BRENGEN
EU / 1/06/356/001
037421017
EU / 1/06/356/002
037421029
EU / 1/06/356/007
09.0 DATUM VAN EERSTE VERGUNNING OF VERLENGING VAN DE VERGUNNING
Datum van eerste vergunning: 28.08.2006
Datum van laatste verlenging: 28.08.2011
10.0 DATUM VAN HERZIENING VAN DE TEKST
D.CCE juli 2015