Actieve ingrediënten: Epoëtine zeta
Retacrit 1 000 IE / 0,3 ml oplossing voor injectie in een voorgevulde spuit
Retacrit 2 000 IE / 0,6 ml oplossing voor injectie in een voorgevulde spuit
Retacrit 3.000 IE / 0,9 ml oplossing voor injectie in voorgevulde spuit
Retacrit 4 000 IE / 0,4 ml oplossing voor injectie in voorgevulde spuit
Retacrit 5 000 IE / 0,5 ml oplossing voor injectie in voorgevulde spuit
Retacrit 6 000 IE / 0,6 ml oplossing voor injectie in een voorgevulde spuit
Retacrit 8 000 IE / 0,8 ml oplossing voor injectie in voorgevulde spuit
Retacrit 10 000 IE / 1 ml oplossing voor injectie in voorgevulde spuit
Retacrit 20 000 IE / 0,5 ml oplossing voor injectie in een voorgevulde spuit
Retacrit 30 000 IE / 0,75 ml oplossing voor injectie in een voorgevulde spuit
Retacrit 40 000 IE / 1 ml oplossing voor injectie in voorgevulde spuit
Indicaties Waarom wordt Retacrit gebruikt? Waar is het voor?
Retacrit bevat een eiwit dat epoëtine zeta wordt genoemd en dat het beenmerg stimuleert om meer rode bloedcellen in het bloed aan te maken die hemoglobine vervoeren (een stof die zuurstof bindt). Epoëtine zeta is een kopie van het menselijke eiwit erytropoëtine en werkt op dezelfde manier.
Retacrit wordt gebruikt:
- bij volwassen, pediatrische en adolescente patiënten die hemodialyse ondergaan, voor de behandeling van symptomatische anemie (verminderd aantal rode bloedcellen) geassocieerd met chronisch nierfalen (nierziekte);
- bij volwassen patiënten die peritoneale dialyse ondergaan, voor de behandeling van symptomatische anemie geassocieerd met chronisch nierfalen (nierziekte);
- bij volwassen patiënten met nierinsufficiëntie die nog geen dialyse ondergaan, voor de behandeling van ernstige anemie geassocieerd met nierziekte die gepaard gaat met klinische symptomen;
- bij volwassen patiënten die chemotherapie krijgen voor solide tumoren, maligne lymfoom (kanker van het lymfestelsel) of multipel myeloom (kanker van het beenmerg) om bloedarmoede te behandelen en de noodzaak van bloedtransfusies te verminderen, als de arts vaststelt dat er een hoog risico op transfusies nodig hebben; - bij patiënten met matige anemie die in aanmerking komen voor een operatie om bloed te doneren vóór de operatie, zodat ze hun eigen bloed kunnen krijgen tijdens of na de operatie (autologe predonatie);
- bij volwassen patiënten met matig bloedarmoede bij wie een grote orthopedische (bot)operatie (bijv. heup- of knievervangende therapie) is ingepland om de noodzaak van bloedtransfusies te verminderen.
Contra-indicaties Wanneer Retacrit niet mag worden gebruikt
Gebruik Retacrit niet:
- als u allergisch bent voor erytropoëtines of voor één van de andere bestanddelen van dit geneesmiddel (vermeld in rubriek 6)
- als u een ziekte heeft ontwikkeld die 'Pure Red Cell Aplasia' (PRCA) wordt genoemd na behandeling met een type erytropoëtine
- als u een hoge bloeddruk heeft die niet voldoende onder controle kan worden gebracht met specifieke geneesmiddelen die de bloeddruk verlagen
- als u geen medicijnen kunt gebruiken om uw bloed te verdunnen
- als u bloed doneert voor de operatie en:
- een hartaanval of beroerte heeft gehad in de maand voor de behandeling
- lijdt aan onstabiele angina pectoris (recente of toenemende pijn op de borst)
- risico lopen op vorming van bloedstolsels in de aderen (diepe veneuze trombose); bijvoorbeeld als u eerder aan trombose heeft geleden.
- Als u op het punt staat een grote orthopedische operatie te ondergaan, zoals een heup- of knievervanging, en:
- ernstige hart- of bloedcirculatieproblemen heeft in aders of slagaders
- onlangs een hartaanval of beroerte heeft gehad.
Voorzorgen bij gebruik Wat u moet weten voordat u Retacrit inneemt
Vertel uw arts voordat u Retacrit gebruikt als u weet dat u aan een van de volgende ziekten heeft geleden of lijdt:
- epileptische aanvallen
- leverziekte
- tumoren
- bloedarmoede door andere oorzaken
- hartziekte (zoals angina pectoris)
- bloedsomloopstoornissen die tintelingen in uw ledematen, koude handen of voeten of spierkrampen in uw benen veroorzaken
- trombose of stollingsziekten
- nierziekte.
Interacties Welke medicijnen of voedingsmiddelen kunnen het effect van Retacrit veranderen
Vertel het uw arts of apotheker als u andere geneesmiddelen gebruikt, kort geleden heeft gebruikt of in de nabije toekomst gaat gebruiken.
In het bijzonder, als u een geneesmiddel gebruikt dat de werkzame stof ciclosporine bevat, om het immuunsysteem te remmen na een niertransplantatie, kan uw arts specifieke tests bestellen om de concentratie van ciclosporine in het bloed te meten tijdens behandeling met Retacrit.
Het gebruik van ijzersupplementen en andere bloedstimulerende middelen kan de werkzaamheid van Retacrit verhogen. Uw arts zal beslissen of u deze stoffen wel of niet moet blijven gebruiken.
Waarschuwingen Het is belangrijk om te weten dat:
Tijdens behandeling met Retacrit
Uw arts zal controleren of uw hemoglobine een bepaald niveau niet overschrijdt, aangezien hoge concentraties hemoglobine een risico kunnen vormen voor de gezondheid van het hart of de bloedvaten en het risico op een hartinfarct, beroerte en overlijden kunnen verhogen.
Artsen moeten proberen het hemoglobinegehalte tussen 10 en 12 g/dl te houden. Het hemoglobinegehalte mag niet hoger zijn dan 12 g / dl.
Uw arts zal uw bloeddruk regelmatig controleren terwijl u Retacrit gebruikt Als u hoofdpijn krijgt, vooral plotselinge, kloppende migraine, of als u zich verward begint te voelen of stuipen krijgt, vertel dit dan onmiddellijk aan uw arts of verpleegkundige.
Deze symptomen kunnen in feite de waarschuwingssignalen zijn van een plotselinge stijging van de bloeddruk, een situatie die een dringende therapeutische interventie vereist.
Tijdens de behandeling met dit geneesmiddel kan een verhoging van het aantal bloedplaatjes (cellen die bijdragen aan de bloedstolling) optreden. Dit fenomeen zou in de loop van de behandeling moeten verbeteren. We raden u aan om uw bloedplaatjes regelmatig te controleren tijdens de eerste 8 weken van de therapie.
Als u een medisch onderzoek ondergaat in een ziekenhuis of een privékliniek, of bloedonderzoek moet ondergaan, denk er dan aan uw arts te informeren over de Retacrit-behandeling die u volgt, aangezien dit geneesmiddel uw toestand en testresultaten kan veranderen.
Let vooral op andere producten die de aanmaak van rode bloedcellen stimuleren:
Retacrit behoort tot een groep producten die de aanmaak van rode bloedcellen stimuleert, net als het menselijke eiwit erytropoëtine. De zorgverlener noteert altijd de exacte naam van het product dat hij gebruikt.
Patiënten met nierziekte
Zeldzame gevallen van Pure Red Cell Aplasia (PRCA) zijn gemeld na maanden of jaren behandeling met andere erytropoëtine-bevattende geneesmiddelen; deze mogelijkheid kan met Retacrit niet worden uitgesloten.
Specifieke rode-cel-aplasie omvat het onvermogen van het beenmerg om voldoende rode bloedcellen te produceren. In dit geval kan een ernstige staat van bloedarmoede optreden, waarvan de symptomen zijn: ongewone vermoeidheid, duizeligheid of kortademigheid. Aplasie van rode bloedcellen kan worden veroorzaakt door de productie van antilichamen die zijn gericht tegen het geïnjecteerde erytropoëtine en vervolgens tegen het erytropoëtine dat door hetzelfde organisme wordt geproduceerd.
Bespreek deze informatie met uw arts. Als deze aplasie, hoe zeldzaam ook, optreedt, zal de behandeling met Retacrit worden gestaakt en zal de arts beslissen wat er moet gebeuren om de bloedarmoede op de meest effectieve manier te behandelen. U moet weten dat als deze complicatie, hoe zeldzaam ook, optreedt, u zult moeten stoppen met het innemen van Retacrit en regelmatig, en mogelijk levenslange, bloedtransfusies moeten krijgen voor de behandeling van bloedarmoede. Vertel het uw arts onmiddellijk als u zich plotseling erg moe of kortademig voelt.Uw arts zal bepalen hoe effectief Retacrit voor u is en de behandeling indien nodig stopzetten.
Patiënten met chronisch nierfalen die worden behandeld met erytropoëtine, moeten regelmatig tests ondergaan om het hemoglobinegehalte (dat deel van de rode bloedcellen dat zuurstof transporteert) te meten totdat een constant niveau is bereikt, en daarna met tussenpozen. risico op een verhoging van de bloeddruk.
Als u chronisch nierfalen heeft, en in het bijzonder als u niet adequaat reageert op Retacrit, zal uw arts de dosis Retacrit die u krijgt controleren, omdat, als u niet op de behandeling reageert, het herhaaldelijk verhogen van de dosis Retacrit het risico op hart- of bloedvaten en kan het risico op een hartinfarct, beroerte en overlijden verhogen.
In geïsoleerde gevallen is een verhoging van de kaliumspiegels in het bloed waargenomen. Bij patiënten met chronisch nierfalen kan correctie van de bloedarmoede leiden tot een toename van de eetlust en de opname van kalium en eiwit.Als u dialysebehandeling ondergaat op het moment dat de behandeling met Retacrit wordt gestart, moet u mogelijk de dialyseparameters aanpassen om ureum, creatinine- en kaliumspiegels binnen het gewenste bereik en uw arts zal beslissen.
Bij patiënten met chronisch nierfalen moeten serumelektrolyten (stoffen die in het bloed worden aangetroffen) worden gecontroleerd. Als de serumkaliumwaarden hoog (of stijgend) zijn, moet worden overwogen om de toediening van Retacrit te staken totdat deze waarden zijn gecorrigeerd.
Tijdens behandeling met Retacrit is het tijdens hemodialyse vaak nodig om de dosis heparine, een bepaalde bloedverdunnende stof, te verhogen om het risico op bloedstolsels te minimaliseren.Als deze dosis heparine niet optimaal is, is het mogelijk dat er een occlusie optreedt in de dialysator.
Kankerpatiënten
Kankerpatiënten hebben meer kans op trombose als ze erytropoëtine-achtige geneesmiddelen gebruiken, zoals Retacrit (zie rubriek 4) U moet daarom met uw arts praten over de voordelen van Retacrit, vooral als u zwaarlijvig bent of eerder last heeft gehad van tromboseproblemen. of bloedstollingsziekten.
Kankerpatiënten die met erytropoëtine worden behandeld, moeten met regelmatige tussenpozen laboratoriumtests ondergaan om het hemoglobinegehalte (dat deel van de rode bloedcellen dat zuurstof transporteert) te meten totdat een constant niveau is bereikt, en daarna periodiek.
Als u kanker heeft, moet u zich ervan bewust zijn dat Retacrit kan werken als een groeifactor voor bloedcellen en dat het in sommige gevallen een negatief effect op de kanker kan hebben. Afhankelijk van de specifieke situatie kan een bloedtransfusie de voorkeur hebben. Bespreek dit met uw arts.
Zwangerschap en borstvoeding
Als u zwanger bent of borstvoeding geeft, denkt zwanger te zijn of van plan bent zwanger te worden, vraag dan uw arts of apotheker om advies voordat u dit geneesmiddel inneemt.
Als u zwanger bent of borstvoeding geeft, mag Retacrit alleen worden gebruikt als de mogelijke voordelen opwegen tegen de mogelijke risico's voor de baby.
Vraag uw arts om advies voordat u een geneesmiddel inneemt.
Rijvaardigheid en het gebruik van machines
Retacrit heeft geen of zeer weinig invloed op de rijvaardigheid of het vermogen om machines te bedienen.
Retacrit bevat fenylalanine
Dit geneesmiddel bevat fenylalanine, een stof die gevaarlijk kan zijn voor mensen met fenylketonurie (een enzymdeficiëntie van genetische oorsprong die een verhoogde eliminatie van een chemische stof (fenylketon) in de urine veroorzaakt en aandoeningen van het zenuwstelsel kan veroorzaken).
Retacrit bevat natrium
Dit geneesmiddel bevat minder dan 1 mmol natrium (23 mg) per dosis, wat betekent dat het als 'natriumvrij' wordt beschouwd.
Dosering en wijze van gebruik Hoe gebruikt u Retacrit: Dosering
Retacrittherapie wordt meestal gestart onder medisch toezicht. Retacrit-injecties kunnen worden gegeven door een arts, geregistreerde verpleegkundige of andere beroepsbeoefenaar in de gezondheidszorg.
Als Retacrit onder de huid (subcutaan) wordt geïnjecteerd, kunt u, nadat u heeft gezien hoe, de oplossing ook zelf injecteren. Gebruik dit geneesmiddel altijd precies zoals uw arts u dat heeft verteld. Als u het niet zeker weet, neem dan contact op met uw arts.
Dosis informatie
Dosering is gebaseerd op lichaamsgewicht in kilogram. Uw arts zal tests bestellen, bijvoorbeeld bloedonderzoeken, om te bepalen of u Retacrit moet gebruiken en zal de exacte dosis Retacrit bepalen, hoe lang u de behandeling moet ondergaan en hoe het geneesmiddel zal worden toegediend. Deze beslissingen zullen afhangen van de oorzaak van de bloedarmoede Uw arts zal de laagste effectieve dosis gebruiken om de symptomen van de bloedarmoede onder controle te houden. Als u niet adequaat reageert op Retacrit, zal uw arts de dosis die u krijgt controleren en u informeren als hij deze verandert.
Voor een grotere effectiviteit van de therapie kunt u zowel voor als tijdens de behandeling met Retacrit ijzersupplementen krijgen.
Gebruik bij patiënten met een nierziekte
Retacrit moet worden toegediend onder de huid (subcutaan) of door injectie in een ader of via een katheter die in een ader wordt geplaatst.
Gebruik van Retacrit bij volwassen patiënten die hemodialyse ondergaan
De arts zal de hemoglobineconcentratie tussen 10 en 12 g/dl (6,2 - 7,5 mmol/l) houden.
Retacrit kan worden toegediend tijdens de dialysesessie of aan het einde van de sessie.
De aanbevolen startdosering is 50 IE/kg (internationale eenheden per kilogram), 3 keer per week gegeven. Als de oplossing in een ader wordt toegediend, moet deze gedurende 1 tot 5 minuten worden geïnjecteerd.
Afhankelijk van hoe uw bloedarmoede op de behandeling reageert, kan deze dosering ongeveer elke 4 weken worden aangepast totdat de situatie onder controle is.Uw arts zal u periodiek bloedonderzoek voorschrijven om er zeker van te zijn dat het geneesmiddel het gewenste effect blijft hebben. Zodra de situatie onder controle is, blijft u Retacrit 2 of 3 keer per week in normale doses gebruiken. Deze doseringen zijn mogelijk niet zo hoog als de aanvankelijk ontvangen doseringen.
Gebruik van Retacrit bij kinderen en adolescenten
(≤18 jaar) onder behandeling van hemodialyse Bij kinderen zal de arts de hemoglobineconcentratie tussen 9,5 en 11 g/dl houden.
Retacrit moet aan het einde van de dialysesessie aan de patiënt worden toegediend.
Dosering bij kinderen en adolescenten is gebaseerd op het lichaamsgewicht in kilogram. De aanbevolen startdosering is 50 IE/kg, 3 maal per week toegediend via injectie in een ader (gedurende 1-5 minuten).
Afhankelijk van hoe de bloedarmoede op de behandeling reageert, kan deze dosering ongeveer elke 4 weken worden aangepast totdat de situatie onder controle is.Uw arts zal periodiek bloedonderzoek laten uitvoeren om er zeker van te zijn dat dit gebeurt.
Gebruik van Retacrit bij volwassen patiënten die peritoneale dialyse ondergaan
De arts zal de hemoglobineconcentratie tussen 10 en 12 g/dl houden.
De aanbevolen startdosering is 50 IE/kg, tweemaal per week toe te dienen.
Afhankelijk van hoe de bloedarmoede op de behandeling reageert, kan deze dosering ongeveer elke 4 weken worden aangepast totdat de situatie onder controle is.
Uw arts zal u regelmatig bloedonderzoek laten doen om er zeker van te zijn dat het geneesmiddel het gewenste effect blijft houden.
Gebruik van Retacrit bij volwassen patiënten met een nierziekte die geen dialyse ondergaan
De aanbevolen startdosering is 50 IE/kg, 3 maal per week gegeven.
Deze startdosering kan door uw arts worden aangepast totdat de situatie onder controle is. Zodra de situatie onder controle is, gaat u door met het innemen van Retacrit in normale doses (3 keer per week, of indien onderhuids (subcutaan) gegeven, kan het ook eenmaal per week of elke 2 weken worden gegeven). meer dan 150 IE/kg 3 keer per week, 240 IE/kg (tot maximaal 20.000 IE) eenmaal per week, of 480 IE/kg (tot maximaal 40.000 IE) eenmaal per week.
Uw arts zal u regelmatig bloedonderzoek laten doen om er zeker van te zijn dat het geneesmiddel het gewenste effect blijft houden.
Als u wordt behandeld met langere doseringsintervallen (meer dan eenmaal per week), is het mogelijk dat u uw Hb-waarden niet voldoende op peil kunt houden en moet u mogelijk uw dosis Retacrit of de toedieningsfrequentie verhogen.
Gebruik van Retacrit bij volwassen patiënten die chemotherapie krijgen
Uw arts kan met Retacrit beginnen als uw hemoglobinegehalte 10 g/dl of minder is.
Na aanvang van de therapie zal de arts de hemoglobineconcentratie tussen 10 en 12 g/dl houden.
De aanbevolen startdosering is 150 IE/kg, 3 maal per week toe te dienen via subcutane injectie. Als alternatief kan uw arts een startdosis van 450 IE/kg eenmaal per week aanbevelen. Uw arts kan uw startdosering aanpassen op basis van uw anemiereactie op de behandeling; u zult Retacrit gedurende 1 maand na het einde van de chemotherapie blijven gebruiken.
Gebruik bij volwassen patiënten die deelnemen aan een autoloog predonatieprogramma
De aanbevolen startdosering is 600 IE/kg, tweemaal per week toegediend via injectie in een ader. Retacrit zal aan u worden gegeven in de 3 weken voor de operatie.U zult ook ijzersupplementen nemen voor en tijdens de behandeling met Retacrit om de werkzaamheid van dit geneesmiddel te verhogen.
Gebruik bij volwassen patiënten bij wie een grote orthopedische (bot)operatie is ingepland
Een dosis van 600 IE/kg wordt eenmaal per week toegediend via injectie onder de huid gedurende 3 weken voorafgaand aan de operatie en op de dag van de operatie. In gevallen waar het nodig is om de tijd voor de interventie te verkorten, wordt een dosis van 300 IE / kg toegediend in de tien dagen voorafgaand aan de interventie, de dag van de interventie en in de 4 volgende dagen. een te hoog hemoglobinegehalte vertoont, wordt de behandeling stopgezet.
Het is ook belangrijk dat het ijzergehalte in het bloed tijdens de behandeling met Retacrit normaal is. Indien nodig krijgt u dagelijks ijzer via de mond, bij voorkeur al voordat u begint met de behandeling met Retacrit.
Informatie over administratie
De Retacrit voorgevulde spuit is klaar voor gebruik. Elke spuit is alleen voor een enkele injectie. Retacrit oplossing voor injectie mag niet worden geschud of gemengd met andere oplossingen.
Als Retacrit onder de huid wordt geïnjecteerd, mag de hoeveelheid die op een enkele plaats wordt geïnjecteerd niet groter zijn dan 1 ml. Het bovenbeen en de buik, weg van de navel, zijn goede injectieplaatsen. Verander elke dag van injectieplaats.
Volg altijd deze instructies wanneer u Retacrit gebruikt:
- Neem de verzegelde blisterverpakking die de spuit bevat en laat deze op kamertemperatuur komen voordat u deze gebruikt. Hiervoor duurt het 15 tot 30 minuten.
- Haal de spuit uit de blisterverpakking en controleer of de oplossing helder, kleurloos en praktisch vrij is van zichtbare deeltjes.
- Verwijder de naalddop en laat de lucht uit de naald en spuit ontsnappen door de spuit rechtop te houden en de zuiger voorzichtig omhoog te duwen.
- Injecteer de oplossing volgens de instructies die uw arts u heeft gegeven. Als u iets niet duidelijk is, raadpleeg dan uw arts of apotheker.
Gebruik Retacrit niet als:
- de blister is open of anderszins beschadigd;
- de oplossing is niet kleurloos of bevat zichtbare deeltjes in suspensie;
- c "Er is vloeistof uit de voorgevulde spuit gelekt of er is condensatie zichtbaar in de blister die nog steeds is verzegeld;
- u weet dat het geneesmiddel per ongeluk is ingevroren of u denkt dat dit is gebeurd.
Overschakelen van intraveneuze naar subcutane toediening
Zodra de situatie onder controle is, blijft u Retacrit in de normale dosering gebruiken. Uw arts kan besluiten dat Retacrit via injectie onder de huid (subcutaan) moet worden toegediend in plaats van in een ader (intraveneus).
Bij het overschakelen van de ene toedieningswijze naar de andere hoeft de dosering niet te worden gewijzigd.Uw arts kan dan bloedonderzoeken laten uitvoeren om te controleren of een dosisaanpassing al dan niet nodig is.
Geef uzelf een injectie met Retacrit onder de huid
Aan het begin van de behandeling wordt Retacrit gewoonlijk toegediend door een arts of verpleegkundige.Daarna kan uw arts u of uw verzorger voorstellen om te leren hoe u onderhuids (subcutaan) moet injecteren.
- Probeer niet uzelf te injecteren als uw arts of verpleegkundige u niet heeft verteld hoe.
- Gebruik Retacrit altijd volgens de instructies van uw arts of verpleegkundige.
- Gebruik het geneesmiddel alleen als het op de juiste manier is bewaard (zie rubriek 5).
- Haal de spuit voor gebruik uit de koelkast en laat deze op kamertemperatuur komen, dit duurt meestal 15-30 minuten.
Gebruik een enkele dosis Retacrit uit elke spuit.
Wanneer het geneesmiddel onder de huid (subcutaan) wordt toegediend, is het volume normaal gesproken niet meer dan 1 ml voor een enkele injectie.
Retacrit moet alleen worden toegediend en niet worden gemengd met andere injectievloeistoffen.
Schud de voorgevulde spuiten niet. Langdurig en krachtig schudden kan het geneesmiddel beschadigen. Gebruik het geneesmiddel niet als het krachtig geschud is.
Hoe u uzelf kunt injecteren met de voorgevulde spuiten
- Haal de spuit uit de koelkast. De vloeistof moet op kamertemperatuur komen. Verwijder de naalddop van de spuit niet als deze op kamertemperatuur komt.
- Controleer de spuit om er zeker van te zijn dat het de juiste dosis is, dat de houdbaarheidsdatum niet is verstreken, dat deze niet is beschadigd en dat de vloeistof helder en niet bevroren is
- Kies de injectieplaats. De meest geschikte plaatsen voor injectie zijn het bovenbeen en de buik, behalve het gebied rond de navel. Verander elke keer van injectieplaats.
- Was je handen. Gebruik een antiseptisch doekje om de injectieplaats te desinfecteren.
- Houd de spuit bij uw lichaam met de afgedekte naald naar boven gericht.
- Houd de spuit niet vast aan de zuigerkop, zuiger of naalddop.
- Trek de zuiger nooit naar u toe.
- Verwijder de naaldbeschermer van de voorgevulde spuit pas als u klaar bent om Retacrit te injecteren.
- Verwijder de dop van de spuit door de cilinder vast te houden en voorzichtig aan de dop te trekken zonder deze te draaien. Duw niet op de zuiger, raak de naald niet aan en schud de spuit niet.
- Neem een huidplooi tussen duim en wijsvinger zonder er teveel in te knijpen.
- Duw de naald helemaal naar binnen. Uw arts of verpleegkundige heeft u laten zien hoe.
- Duw de zuiger met uw duim helemaal naar binnen om de volledige hoeveelheid vloeistof te injecteren.Duw hem langzaam en gelijkmatig, waarbij u de huid samengeknepen houdt.
- Wanneer de zuiger tot het uiterste is geduwd, trekt u de naald eruit en laat u de huid los.
- Wanneer de naald uit de huid wordt verwijderd, kan er wat bloed uit de injectieplaats lekken. Dit is normaal. U kunt de injectieplaats desinfecteren door enkele seconden na de injectie op het antiseptische doekje te drukken.
- Plaats de gebruikte spuit in een naaldencontainer. Probeer de beschermkap niet terug op de naald te plaatsen.
- Gooi gebruikte spuiten nooit in de containers voor huishoudelijk afval.
Gebruik van het naaldbeschermingsapparaat
De voorgevulde spuit kan worden uitgerust met een veiligheidsvoorziening voor de naald die beschermt tegen onbedoelde naaldprikken.
- Voer de injectie uit volgens de hierboven beschreven techniek.
- Terwijl u de spuit vasthoudt met uw vingers op de steunrand, oefent u druk uit op de zuiger totdat de injectie van de volledige dosis is voltooid. Het naaldbeschermingssysteem wordt NIET geactiveerd als de VOLLEDIGE dosis niet is toegediend.
- Verwijder de naald van uw huid, laat de zuiger los en de spuit zal naar voren bewegen totdat het schild de naald heeft bedekt en op zijn plaats klikt.
Bent u vergeten Retacrit te gebruiken?
Gebruik geen dubbele dosis om een vergeten eerdere dosis in te halen.
Als u stopt met het innemen van Retacrit
Stop niet met de behandeling zonder eerst met uw arts te overleggen.
Als u nog vragen heeft over het gebruik van Retacrit, neem dan contact op met uw arts.
Overdosering Wat moet u doen als u te veel Retacrit heeft ingenomen?
Retacrit heeft een grote veiligheidsmarge en bijwerkingen van een overdosis van dit geneesmiddel zijn onwaarschijnlijk. Vertel het uw arts of verpleegkundige meteen als u denkt dat u te veel Retacrit heeft geïnjecteerd.
Bijwerkingen Wat zijn de bijwerkingen van Retacrit
Zoals elk geneesmiddel kan ook dit geneesmiddel bijwerkingen hebben, al krijgt niet iedereen daarmee te maken.
Vertel het uw arts onmiddellijk als u hoofdpijn heeft, vooral als het plotselinge, scherpe, migraine-achtige hoofdpijn is, als u zich verward voelt of als u stuipen heeft Deze symptomen kunnen waarschuwingssignalen zijn van een plotselinge stijging bloeddruk, waarvoor een spoedeisende hulp nodig is. behandeling.
Vertel het uw arts of verpleegkundige als u een van de effecten op deze lijst opmerkt.
Zeer vaak voorkomende bijwerkingen
Deze kunnen voorkomen bij meer dan 1 op de 10 mensen die met Retacrit worden behandeld.
- Griepachtige symptomen, hoofdpijn, gewrichtspijn, gevoel van zwakte, vermoeidheid en duizeligheid.
- Bij patiënten met een nierziekte die nog geen dialyse ondergaan, is congestie van de luchtwegen, zoals verstopte neus en keelpijn, gemeld.
Vaak voorkomende bijwerkingen
Deze kunnen voorkomen bij maximaal 1 op de 10 mensen die met Retacrit worden behandeld.
- Verhoogde bloeddruk. De stijging van de bloeddruk kan behandeling met medicijnen vereisen (of aanpassing van de medicijnen die u al krijgt voor uw hoge bloeddruk). Uw arts zal uw bloeddruk regelmatig controleren tijdens de behandeling met Retacrit, vooral tijdens de behandeling met Retacrit. " begin van de therapie.
- Pijn op de borst, kortademigheid, pijnlijke zwelling in de benen, wat een symptoom kan zijn van bloedstolsels (longembolie, diepe veneuze trombose).
- Beroerte (onvoldoende bloedtoevoer naar de hersenen, waardoor het onvermogen om een of meer ledematen aan één kant van het lichaam te bewegen, onvermogen om te begrijpen of te spreken, of onvermogen om één kant van het gezichtsveld te zien) kan ontstaan.
- Huiduitslag en zwelling rond de ogen (oedeem), die veroorzaakt kunnen worden door een allergische reactie.
- Coagulatie in de kunstnier.
Soms voorkomende bijwerkingen
Deze kunnen voorkomen bij maximaal 1 op de 100 mensen die met Retacrit worden behandeld.
- Hersenbloeding.
Zeldzame bijwerkingen
Deze kunnen voorkomen bij maximaal 1 op de 1000 mensen die met Retacrit worden behandeld.
- Overgevoeligheidsreacties.
Zeer zeldzame bijwerkingen
Deze kunnen voorkomen bij maximaal 1 op de 10.000 mensen die met Retacrit worden behandeld.
- Er kunnen verhogingen zijn van het aantal bloedplaatjes, die normaal gesproken betrokken zijn bij de vorming van bloedstolsels. De arts zal deze waarden controleren.
Bijwerkingen waarvan de frequentie niet bekend is
De frequentie van deze bijwerkingen kan op basis van de beschikbare gegevens niet worden berekend.
- Zwelling, vooral rond de ogen en lippen (Quincke's oedeem) en shock-achtige allergische reacties met symptomen zoals tintelingen, roodheid, jeuk, blozen en snelle pols.
- Vasculaire en trombotische voorvallen (bloedstolsels) in bloedvaten zoals belemmerde bloedtoevoer naar de hersenen, retinale trombose, belemmerde bloedtoevoer naar het hart, hartaanval, arteriële trombose, verwijding van de bloedvatwanden (aneurysma).
- Red Series Aplasia (PRCA) PRCA is gemeld bij patiënten na maanden tot jaren subcutane (injectie onder de huid) behandeling van erytropoëtine. PRCA betekent het onvermogen om een voldoende aantal rode bloedcellen in het beenmerg aan te maken (zie rubriek "Wanneer moet u extra voorzichtig zijn met dit middel?').
- Jeuk.
Andere bijwerkingen
Patiënten met nierziekte
- Verhoging van de bloeddruk, waarvoor medicamenteuze behandeling nodig kan zijn of een aanpassing van de dosering van geneesmiddelen die u al gebruikt voor hoge bloeddruk. Uw arts kan uw bloeddruk regelmatig meten terwijl u Retacrit gebruikt, vooral aan het begin van de behandeling.
- Een afsluiting van de verbinding tussen slagader en ader (shunttrombose) kan met name optreden als u een lage bloeddruk heeft of als u complicaties heeft van arterioveneuze fistels.Uw arts kan de shunt controleren en een geneesmiddel voorschrijven om trombose te voorkomen.
Patiënten met kwaadaardige tumoren
- Bloedstolling (vasculaire trombotische voorvallen) (zie rubriek "Waarschuwingen en voorzorgen").
- Verhoogde bloeddruk. Om deze reden moeten de hemoglobinespiegels en bloeddruk worden gecontroleerd.
Krijgt u last van bijwerkingen, neem dan contact op met uw arts, apotheker of verpleegkundige.Dit geldt ook voor alle bijwerkingen die niet in deze bijsluiter staan.
Melding van bijwerkingen
Krijgt u last van bijwerkingen, neem dan contact op met uw arts.Dit geldt ook voor mogelijke bijwerkingen die niet in deze bijsluiter staan. U kunt bijwerkingen ook rechtstreeks melden via het nationale meldsysteem zoals vermeld in aanhangsel V. Door bijwerkingen te melden, kunt u ons helpen meer informatie te verkrijgen over de veiligheid van dit geneesmiddel.
Vervaldatum en retentie
Buiten het zicht en bereik van kinderen houden.
Gebruik dit geneesmiddel niet meer na de uiterste houdbaarheidsdatum. Die is te vinden op het etiket en de doos ("EXP" / "EXP").
De vervaldatum verwijst naar de laatste dag van de maand.
Bewaren in de koelkast (2 ° C - 8 ° C). Niet bevriezen.
De spuit kan uit de koelkast worden gehaald en gedurende een enkele periode van maximaal 3 dagen (maar niet boven 25°C) op kamertemperatuur worden bewaard.
Bewaar de voorgevulde spuit in de buitenverpakking om het geneesmiddel tegen licht te beschermen.
Geneesmiddelen niet weggooien via het afvalwater of met huishoudelijk afval Vraag uw apotheker wat u met geneesmiddelen moet doen die u niet meer gebruikt, dit helpt het milieu te beschermen.
Deadline "> Overige informatie
Wat bevat Retacrit
Het werkzame bestanddeel is epoëtine zeta (geproduceerd door middel van recombinant-DNA-techniek in ovariumcellijnen van Chinese hamsters).
Retacrit 1 000 IE / 0,3 ml oplossing voor injectie in een voorgevulde spuit
1 voorgevulde spuit met 0,3 ml oplossing voor injectie bevat 1 000 internationale eenheden (IE) epoëtine zeta (recombinant humaan erytropoëtine). De oplossing bevat 3 333 IE epoëtine zeta per ml.
Retacrit 2 000 IE / 0,6 ml oplossing voor injectie in een voorgevulde spuit
1 voorgevulde spuit met 0,6 ml oplossing voor injectie bevat 2.000 internationale eenheden (IE) epoëtine zeta (recombinant humaan erytropoëtine). De oplossing bevat 3 333 IE epoëtine zeta per ml.
Retacrit 3.000 IE / 0,9 ml oplossing voor injectie in voorgevulde spuit
1 voorgevulde spuit met 0,9 ml oplossing voor injectie bevat 3.000 internationale eenheden (IE) epoëtine zeta (recombinant humaan erytropoëtine). De oplossing bevat 3 333 IE epoëtine zeta per ml.
Retacrit 4 000 IE / 0,4 ml oplossing voor injectie in voorgevulde spuit
1 voorgevulde spuit met 0,4 ml oplossing voor injectie bevat 4 000 internationale eenheden (IE) epoëtine zeta (recombinant humaan erytropoëtine). De oplossing bevat 10.000 IE epoëtine zeta per ml.
Retacrit 5 000 IE / 0,5 ml oplossing voor injectie in voorgevulde spuit
1 voorgevulde spuit met 0,5 ml oplossing voor injectie bevat 5000 internationale eenheden (IE) epoëtine zeta (recombinant humaan erytropoëtine). De oplossing bevat 10.000 IE epoëtine zeta per ml.
Retacrit 6 000 IE / 0,6 ml oplossing voor injectie in een voorgevulde spuit
1 voorgevulde spuit met 0,6 ml oplossing voor injectie bevat 6 000 internationale eenheden (IE) epoëtine zeta (recombinant humaan erytropoëtine). De oplossing bevat 10.000 IE epoëtine zeta per ml.
Retacrit 8 000 IE / 0,8 ml oplossing voor injectie in voorgevulde spuit
1 voorgevulde spuit met 0,8 ml oplossing voor injectie bevat 8 000 internationale eenheden (IE) epoëtine zeta (recombinant humaan erytropoëtine). De oplossing bevat 10.000 IE epoëtine zeta per ml.
Retacrit 10 000 IE / 1 ml oplossing voor injectie in voorgevulde spuit
1 voorgevulde spuit met 1,0 ml oplossing voor injectie bevat 10.000 internationale eenheden (IE) epoëtine zeta (recombinant humaan erytropoëtine). De oplossing bevat 10.000 IE epoëtine zeta per ml.
Retacrit 20 000 IE / 0,5 ml oplossing voor injectie in een voorgevulde spuit
1 voorgevulde spuit met 0,5 ml oplossing voor injectie bevat 20 000 internationale eenheden (IE) epoëtine zeta (recombinant humaan erytropoëtine). De oplossing bevat 40 000 IE epoëtine zeta per ml.
Retacrit 30 000 IE / 0,75 ml oplossing voor injectie in een voorgevulde spuit
1 voorgevulde spuit met 0,75 ml oplossing voor injectie bevat 30.000 internationale eenheden (IE) epoëtine zeta (recombinant humaan erytropoëtine). De oplossing bevat 40 000 IE epoëtine zeta per ml.
Retacrit 40 000 IE / 1 ml oplossing voor injectie in voorgevulde spuit
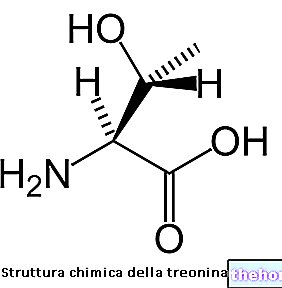
1 voorgevulde spuit met 1,0 ml oplossing voor injectie bevat 40.000 internationale eenheden (IE) epoëtine zeta (recombinant humaan erytropoëtine). De oplossing bevat 40 000 IE epoëtine zeta per ml. De andere stoffen in dit middel zijn dinatriumfosfaatdihydraat, monobasisch natriumfosfaatdihydraat, natriumchloride, calciumchloridedihydraat, polysorbaat 20, glycine, leucine, isoleucine, threonine, glutaminezuur, fenylalanine en water voor injecties, natriumhydroxide (voor pH-aanpassing), zoutzuur (om de pH aan te passen).
Hoe ziet Retacrit eruit en hoeveel zit er in een verpakking?
Retacrit is een heldere en kleurloze oplossing voor injectie in doorzichtige, kleurloze glazen injectiespuiten met een vaste naald.
De voorgevulde spuiten bevatten 0,3 ml tot 1 ml oplossing, afhankelijk van de inhoud van epoëtine zeta (zie rubriek "Wat bevat Retacrit").
Een verpakking bevat 1 of 4 of 6 voorgevulde spuiten met of zonder naaldbeschermer.
Multiverpakkingen bevatten 4 (4 verpakkingen van 1) of 6 (6 verpakkingen van 1) voorgevulde spuiten.
Bron Bijsluiter: AIFA (Italiaans Geneesmiddelenbureau). Inhoud gepubliceerd in januari 2016. De aanwezige informatie is mogelijk niet up-to-date.
Om toegang te hebben tot de meest actuele versie, is het raadzaam om de website van AIFA (Italian Medicines Agency) te bezoeken. Disclaimer en nuttige informatie.
01.0 NAAM VAN HET GENEESMIDDEL -
RETACRIT 1000 IE / 0,3 ML OPLOSSING VOOR INJECTIE IN VOORGEVULDE SPUIT
02.0 KWALITATIEVE EN KWANTITATIEVE SAMENSTELLING -
Eén voorgevulde spuit met 0,3 ml oplossing voor injectie bevat 1 000 internationale eenheden (IE) epoëtine zeta* (recombinant humaan erytropoëtine). De oplossing bevat 3 333 IE epoëtine zeta per ml.
* Geproduceerd door middel van recombinant-DNA-techniek in cellijnen van de eierstokken van de Chinese hamster (CHO).
Hulpstof met bekend effect:
Elke voorgevulde spuit bevat 0,15 mg fenylalanine.
Voor de volledige lijst van hulpstoffen, zie rubriek 6.1.
03.0 FARMACEUTISCHE VORM -
Oplossing voor injectie in voorgevulde spuit.
Heldere en kleurloze oplossing.
04.0 KLINISCHE INFORMATIE -
04.1 Therapeutische indicaties -
• Behandeling van symptomatische anemie geassocieerd met chronisch nierfalen (CRI) bij volwassen en pediatrische patiënten:
• Behandeling van anemie geassocieerd met chronisch nierfalen bij volwassen en pediatrische patiënten die hemodialyse ondergaan en bij volwassen patiënten die peritoneale dialyse ondergaan (zie rubriek 4.4).
• Behandeling van ernstige anemie van renale oorsprong met klinische symptomen bij volwassen patiënten met nierinsufficiëntie die nog geen dialyse ondergaan (zie rubriek 4.4).
- Behandeling van anemie en vermindering van de behoefte aan transfusie bij volwassen patiënten die chemotherapie ondergaan voor solide tumoren, maligne lymfoom of multipel myeloom en die een risico lopen op bloedtransfusie zoals aangegeven door de algemene toestand van de patiënt (cardiovasculaire situatie, anemie die al bestond bij het begin van chemotherapie) .
- Retacrit kan worden gebruikt om de hoeveelheid autoloog bloed te verhogen bij patiënten die deelnemen aan een predonatieprogramma. Gebruik bij deze indicatie moet worden geëvalueerd in het licht van de gemelde risico's van trombo-embolische voorvallen. De behandeling mag alleen worden gereserveerd voor patiënten met matige anemie (bij afwezigheid van ijzertekort) als bloedconserveringsprocedures niet beschikbaar of onvoldoende zijn wanneer "geplande grote electieve chirurgie vereist een grote hoeveelheid bloed (4 of meer eenheden bloed voor vrouwen, 5 of meer eenheden voor mannen).
- Retacrit kan worden gebruikt om de blootstelling aan allogene bloedtransfusies te verminderen bij volwassen patiënten zonder ijzertekort waarvan wordt aangenomen dat ze een hoog risico lopen op transfusiecomplicaties voorafgaand aan grote electieve orthopedische chirurgie. Gebruik beperken tot patiënten met matige anemie (Hb 10-13 g/dl ) die geen deel uitmaken van een autoloog predonatieprogramma en waarvoor matig bloedverlies wordt verwacht (van 900 tot 1 800 ml).
04.2 Dosering en wijze van toediening -
De behandeling met Retacrit dient te worden gestart onder toezicht van medisch personeel dat ervaring heeft met de behandeling van patiënten met de hierboven beschreven indicaties.
Dosering
Behandeling van symptomatische anemie bij volwassen en pediatrische patiënten met chronisch nierfalen
Retacrit moet subcutaan of intraveneus worden toegediend.
De gewenste hemoglobineconcentratie ligt tussen 10 en 12 g/dl (6,2-7,5 mmol/l), behalve bij pediatrische patiënten, waar de hemoglobineconcentratie tussen 9,5 en 11 g/dl (5,9-6,8 mmol/l) moet liggen. De bovengrens van de beoogde hemoglobineconcentratie mag niet worden overschreden. Symptomen en gevolgen van bloedarmoede kunnen variëren met leeftijd, geslacht en algehele ziektelast; het is noodzakelijk dat het klinische beloop en de toestand van de individuele patiënt door de arts worden beoordeeld. Retacrit moet subcutaan of intraveneus worden toegediend om hemoglobinewaarden te bereiken die niet hoger zijn dan 12 g / dl (7,5 mmol / l). Vanwege de variabiliteit binnen de patiënt kunnen af en toe enkele hemoglobinewaarden boven en onder de gewenste hemoglobineconcentratie worden waargenomen bij een patiënt. Variabiliteit in hemoglobine moet worden beheerd door middel van dosisaanpassing, verwijzend naar een streefbereik voor hemoglobine tussen 10 g / dl (6,2 mmol / l) en 12 g / dl (7,5 mmol / l).
Een langdurig hemoglobinegehalte boven 12 g/dl (7,5 mmol/l) dient te worden vermeden; aanwijzingen voor een geschikte dosisaanpassing voor wanneer hemoglobinewaarden boven 12 g / dl (7,5 mmol / l) worden waargenomen, worden hieronder gegeven. Een hemoglobinestijging van meer dan 2 g/dl (1,25 mmol/l) over een periode van vier weken moet worden vermeden. Als dit gebeurt, dient de juiste dosering te worden aangepast zoals aangegeven.
Patiënten moeten nauwlettend worden gecontroleerd om ervoor te zorgen dat de laagst toegestane effectieve dosis Retacrit wordt gebruikt om de symptomen van anemie adequaat onder controle te houden door een hemoglobineconcentratie van minder dan of gelijk aan 12 g/dl (7,5 mmol/l) te handhaven.
Voorzichtigheid is geboden bij het verhogen van de doses Retacrit bij patiënten met chronisch nierfalen Bij patiënten met een slechte hemoglobinerespons op Retacrit moeten alternatieve verklaringen voor deze slechte respons worden overwogen (zie rubrieken 4.4 en 5.1) Bij patiënten met chronische nierinsufficiëntie ziekte en klinisch bewijs van ischemische hartziekte of congestief hartfalen, mag de onderhoudsconcentratie van hemoglobine de maximale doelconcentratie niet overschrijden.
Volwassen patiënten die hemodialyse ondergaan
Retacrit moet subcutaan of intraveneus worden toegediend.
De behandeling is opgedeeld in twee fasen:
1. Correctiefase: 50 IE/kg, 3 keer per week. Indien dosisaanpassing nodig is, dient dit geleidelijk te gebeuren, met tussenpozen van ten minste 4 weken. Bij elke aanpassing moet de dosis 3 keer per week met 25 IE/kg worden verhoogd of verlaagd.
2. Onderhoudsfase: Doseringsaanpassing gericht op het op peil houden van het gewenste hemoglobinegehalte (Hb), tussen 10 en 12 g/dl (6,2-7,5 mmol/l). De aanbevolen totale wekelijkse dosis varieert van 75 tot 300 IE/kg.
Beschikbare klinische gegevens geven aan dat patiënten met een zeer laag aanvankelijk hemoglobinegehalte (8 g/dl of > 5 mmol/l).
Pediatrische patiënten die hemodialyse ondergaan
De behandeling is opgedeeld in twee fasen.
1. Correctiefase 50 IE/kg, 3 maal per week intraveneus. Als de dosering moet worden aangepast, moet dit worden gedaan in stappen van 25 IE/kg 3 keer per week, met tussenpozen van ten minste 4 weken, totdat het doel is bereikt.
2. Onderhoudsfase Doseringsaanpassing gericht op het handhaven van het gewenste niveau van hemoglobine (Hb), tussen 9,5 en 11 g/dl (5,9-6,8 mmol/l).
Over het algemeen hebben kinderen en adolescenten die minder dan 30 kg wegen een hogere onderhoudsdosering nodig dan kinderen die meer dan 30 kg wegen en volwassenen. In klinische onderzoeken werden bijvoorbeeld de volgende onderhoudsdoses waargenomen na 6 maanden behandeling:
Beschikbare klinische gegevens geven aan dat patiënten met een zeer laag aanvankelijk hemoglobinegehalte (6,8 g/dl of > 4,25 mmol/l).
Volwassen patiënten die peritoneale dialyse ondergaan
Retacrit moet subcutaan of intraveneus worden toegediend.
De behandeling is opgedeeld in twee fasen.
1. Correctiefase: De startdosering is 50 IE/kg gewicht, tweemaal per week.
2. Onderhoudsfase: Doseringsaanpassing gericht op het op peil houden van het gewenste hemoglobinegehalte (Hb), (tussen 10 en 12 g/dl [6,2-7,5 mmol/l]. De onderhoudsdosis ligt tussen 25 en 50 IE/kg 2 maal daags week, verdeeld over 2 gelijke doses.
Volwassen patiënten met nierinsufficiëntie die nog niet gedialyseerd worden
Retacrit moet subcutaan of intraveneus worden toegediend.
De behandeling is opgedeeld in twee fasen.
1. Correctiefase: Een aanvangsdosis van 50 IE/kg 3 keer per week, indien nodig gevolgd door een verhoging in stappen van 25 IE/kg (3 keer per week) totdat het gewenste doel is bereikt (de verhoging dient geleidelijk te gebeuren, met tussenpozen van minimaal vier weken).
2. Onderhoudsfase: Tijdens de onderhoudsfase kan Retacrit 3 maal per week en bij subcutane toediening eenmaal per week of eenmaal per twee weken worden toegediend. De dosis en doseringsintervallen moeten correct worden aangepast om het gewenste hemoglobine (Hb) niveau te behouden, (tussen 10 en 12 g/dl [6.2-7.5 mmol/l].
Het verlengen van het doseringsinterval kan een dosisverhoging vereisen.
De maximale dosis mag niet hoger zijn dan 150 IE/kg 3 keer per week, 240 IE/kg (tot een maximum van 20.000 IE) eenmaal per week of 480 IE/kg (tot een maximum van 40.000 IE) eenmaal per week elke 2 weken.
Behandeling van patiënten met door chemotherapie geïnduceerde anemie
Retacrit dient subcutaan te worden toegediend aan anemische patiënten (bijv. met een hemoglobineconcentratie ≤ 10 g/dl (6,2 mmol/l). De symptomen en gevolgen van anemie kunnen variëren afhankelijk van leeftijd, geslacht en ernst. algehele ziekte; een individuele beoordeling van de klinische beloop en toestand van elke individuele patiënt wordt vereist door de arts.
Met het oog op de variabiliteit binnen de patiënt kunnen af en toe enkele hemoglobinewaarden boven en onder het gewenste hemoglobinegehalte bij een patiënt worden gedetecteerd. Variabiliteit in hemoglobine moet worden beheerd door middel van dosisaanpassing, in verhouding tot een streefbereik voor hemoglobine van 10 g/dl (6,2 mmol/l) tot 12 g/dl (7,5 mmol/l). Een langdurig hemoglobinegehalte boven 12 g/dl (7,5 mmol/l) dient te worden vermeden; aanwijzingen voor een geschikte dosisaanpassing voor wanneer hemoglobinewaarden boven 12 g / dl (7,5 mmol / l) worden waargenomen, worden hieronder gegeven.
Patiënten moeten nauwlettend worden gecontroleerd om er zeker van te zijn dat de laagst toegestane dosis Retacrit wordt gebruikt om de symptomen van anemie adequaat onder controle te houden.
De behandeling met Retacrit moet na het einde van de chemotherapie nog een maand worden voortgezet. De startdosering is 150 IE/kg, 3 maal per week subcutaan. Als alternatief kan Retacrit subcutaan worden toegediend in een startdosering van 450 IE/kg eenmaal per week. Als na 4 weken behandeling de hemoglobine is gestegen met ten minste 1 g/dl (0,62 mmol/l) of als het aantal reticulocyten is toegenomen met ≥ 40.000 cellen/μl vanaf de uitgangswaarde, moet de dosis eenmaal per week 450 IE/kg blijven of 150 IE / kg 3 keer per week. Als de hemoglobineverhoging is
Het aanbevolen doseringsschema wordt weergegeven in de volgende tabel:
Zodra het therapeutische doel voor de individuele patiënt is bereikt, moet de dosis met 25 tot 50% worden verlaagd om hemoglobine op dat niveau te houden. Een geschikte dosistitratie moet worden overwogen.
Doseringsaanpassing
Als de hemoglobinetoename groter is dan 2 g/dl (> 1,25 mmol/l) per maand, moet de dosis Retacrit met ongeveer 25-50% worden verlaagd.Als de hemoglobinewaarde hoger is dan 12 g/dl (7,5 mmol/L) ), onderbreek de therapie totdat deze terugkeert naar of daalt tot onder 12 g/dL (7,5 mmol/L), en hervat dan de Retacrit-therapie met een dosis die lager is dan 25% dan de vorige dosis.
Behandeling van volwassen patiënten die in aanmerking komen voor chirurgische ingrepen die deel uitmaken van autologe predonatieprogramma's
Retacrit moet intraveneus worden toegediend.
Op het moment van bloeddonatie moet Retacrit worden toegediend nadat de donatieprocedure is voltooid.
Licht anemische patiënten (hematocriet 33-39%) die een predeposito van ≥ 4 eenheden bloed nodig hebben, moeten 3 weken voorafgaand aan de operatie 2 keer per week worden behandeld met 600 IE/kg Retacrit.
Gedurende de gehele duur van de behandeling met Retacrit dienen alle patiënten adequate ijzersuppletie te krijgen (bijv. 200 mg oraal elementair ijzer per dag). De toediening van ijzer moet zo snel mogelijk worden gestart, zelfs enkele weken voordat de autologe predeposit wordt uitgevoerd, om de ijzervoorraad te vergroten voordat met de behandeling met Retacrit wordt begonnen.
Behandeling van volwassen patiënten die voor een grote electieve orthopedische ingreep zijn ingepland
Retacrit dient subcutaan te worden toegediend.
Een dosis van 600 IE/kg lichaamsgewicht dient eenmaal per week te worden toegediend gedurende drie weken (dag 21, 14 en 7) voorafgaand aan de operatie en op de dag van de operatie (dag 0). In gevallen waarin het nodig is de tijd vóór de operatie te verkorten tot minder dan drie weken, dient een dagelijkse dosis van 300 IE/kg lichaamsgewicht te worden toegediend gedurende 10 opeenvolgende dagen vóór de operatie, op de dag van de operatie en in de vier dagen. als het hemoglobinegehalte 15 g/dl bereikt of overschrijdt als onderdeel van hematologische tests uitgevoerd in de preoperatieve periode, moet Retacrit worden gestaakt en mogen geen volgende doses worden toegediend.
IJzertekorten moeten worden behandeld voordat de behandeling met Retacrit wordt gestart. Bovendien moet een adequate hoeveelheid ijzer worden toegediend aan alle patiënten die met Retacrit worden behandeld (bijv. 200 mg ijzerionen oraal per dag) voor de gehele duur van de behandeling met Retacrit ijzertoediening voorafgaand aan de behandeling met Retacrit om voldoende afzettingen te verkrijgen.
Wijze van toediening
Intraveneuze injectie
De toediening moet minstens 1-5 minuten duren, afhankelijk van de totale dosis. Bij hemodialysepatiënten is het mogelijk om de bolusdosis tijdens de dialysesessie toe te dienen vanuit een geschikte veneuze toegang van het dialysecircuit. Als alternatief kan de stof aan het einde van de dialysesessie via de fistel worden geïnjecteerd en gevolgd door 10 ml fysiologische NaCl-oplossing van 9 mg/ml (0,9%) om het circuit te irrigeren en een bevredigende introductie van het product in de bloedsomloop te verzekeren. Bij patiënten die op een behandeling reageren met griepachtige verschijnselen verdient het de voorkeur om te kiezen voor een langzamere toediening.
Retacrit mag niet via intraveneuze infusie worden toegediend.
Retacrit mag niet gemengd worden met andere geneesmiddelen (zie rubriek 6.2).
Subcutane injectie
Over het algemeen mag het maximale volume van 1 ml per injectieplaats niet worden overschreden.Bij grotere volumes is het noodzakelijk om meer toedieningsplaatsen te kiezen.
Injecties worden gegeven in de ledematen of in de voorste buikwand.
Voor instructies over hantering van het geneesmiddel voorafgaand aan toediening, zie rubriek 6.6.
04.3 Contra-indicaties -
- Overgevoeligheid voor de werkzame stof of voor één van de in rubriek 6.1 vermelde hulpstoffen.
- Patiënten met pure rode-cel-aplasie (PRCA) na behandeling met erytropoëtine mogen geen therapie met Retacrit of andere soorten erytropoëtine ondergaan (zie rubriek 4.4).
- Ongecontroleerde hypertensie.
- Bij de indicatie "toename van de hoeveelheid autoloog bloed": myocardinfarct of beroerte in de maand voorafgaand aan de behandeling, onstabiele angina pectoris, verhoogd risico op diepe veneuze trombose zoals een voorgeschiedenis van trombo-embolische veneuze ziekte.
- Bij de indicatie van grote electieve orthopedische chirurgie: ernstige coronaire, perifere arteriële, carotis- of cerebrale vasculaire aandoeningen, inclusief patiënten met een recent myocardinfarct of cerebrovasculair accident.
- Patiënten die om welke reden dan ook geen "adequate antitrombotische profylaxe" kunnen krijgen.
04.4 Bijzondere waarschuwingen en passende voorzorgen bij gebruik -
Algemene informatie
Zoals bij alle patiënten die erytropoëtine krijgen, kan tijdens de behandeling met Retacrit een verhoging van de bloeddruk optreden. De bloeddruk moet zorgvuldig worden gecontroleerd en adequaat worden gecontroleerd vóór, bij het begin en tijdens de behandeling met Retacrit, zowel bij alle patiënten die voor de eerste keer met epoëtine worden behandeld als bij patiënten die al worden behandeld. -hypertensieve behandeling Als de bloeddruk niet onder controle kan worden gebracht, moet de behandeling met Retacrit worden stopgezet.
Retacrit moet ook met voorzichtigheid worden gebruikt bij epilepsie en chronisch leverfalen.
Tijdens behandeling met erytropoëtine kan een matige dosisafhankelijke stijging van het aantal bloedplaatjes binnen het normale bereik optreden. Dit fenomeen neemt af bij voortzetting van de therapie. Het wordt aanbevolen het aantal bloedplaatjes regelmatig te controleren tijdens de eerste 8 weken van de behandeling.
Alle andere oorzaken van anemie (ijzertekort, hemolyse, bloedverlies, vitamine B12- of foliumzuurdeficiëntie) moeten vóór en tijdens de behandeling met Retacrit worden geëvalueerd en behandeld. In de meeste gevallen nemen de serum-ferritinewaarden af terwijl de hematocrietwaarden stijgen.Om een optimale respons op erytropoëtine te garanderen, moeten voldoende ijzerreserves worden gegarandeerd:
- bij patiënten met chronische nierinsufficiëntie en serum-ferritinespiegels lager dan 100 ng/ml wordt ijzersuppletie aanbevolen, bijvoorbeeld 200-300 mg/dag oraal (100-200 mg/dag bij pediatrische patiënten);
- Bij alle kankerpatiënten met transferrineverzadigingswaarden lager dan 20% wordt een oraal ijzersupplement van 200-300 mg/dag aanbevolen.
Al deze factoren die bijdragen aan het ontstaan van anemie moeten ook zorgvuldig worden overwogen voordat wordt besloten de dosis erytropoëtine bij kankerpatiënten te verhogen.
Een paradoxale afname van hemoglobine en de ontwikkeling van ernstige anemie geassocieerd met een laag aantal reticulocyten zou hen moeten waarschuwen om de behandeling met epoëtine te staken en anti-erytropoëtine-antilichaamtesten uit te voeren. Er zijn gevallen gemeld bij patiënten met hepatitis C die werden behandeld met interferon en ribavirine. Epoëtinen zijn niet goedgekeurd voor de behandeling van anemie geassocieerd met hepatitis C.
Om de traceerbaarheid van erytropoësestimulerende middelen te verbeteren (Erytropiese stimulerende middelen (ESA), moet de naam van de ESA die is voorgeschreven duidelijk worden vastgelegd (of aangegeven) in het medisch dossier van de patiënt.
Goede praktijken op het gebied van bloedbeheer moeten altijd worden toegepast in de perioperatieve periode.
Patiënten die zijn ingepland voor een grote electieve orthopedische operatie
Bij patiënten die voor een grote electieve orthopedische operatie zijn ingepland, moeten de oorzaken van de anemie worden vastgesteld en behandeld, mogelijk voordat de behandeling met Retacrit wordt gestart. Trombotische voorvallen kunnen een risico vormen bij deze patiëntenpopulatie en dit moet zorgvuldig worden overwogen in relatie tot het verwachte voordeel van de behandeling. Patiënten dienen adequate antitrombotische profylaxe te krijgen, aangezien trombotische en vasculaire voorvallen kunnen optreden bij chirurgische patiënten, vooral bij patiënten met een onderliggende cardiovasculaire aandoening. Bovendien moet bijzondere voorzichtigheid worden betracht bij patiënten die vatbaar zijn voor het ontwikkelen van diepe veneuze trombose (DVT). Bij patiënten met baseline hemoglobine > 13 g/dl kan de mogelijkheid dat behandeling met Retacrit gepaard gaat met een verhoogd risico op postoperatieve trombotische/vasculaire voorvallen niet worden uitgesloten.Daarom mag een dergelijke behandeling niet worden gebruikt bij patiënten met baseline hemoglobine > 13 g/dl .
Patiënten met chronische nierinsufficiëntie
Hemoglobineconcentratie
Bij patiënten met chronisch nierfalen mag de hemoglobine-onderhoudsconcentratie de bovengrens van de in rubriek 4.2 aanbevolen hemoglobineconcentratie niet overschrijden. Verhoogd risico op overlijden, ernstige cardiovasculaire voorvallen en cerebrovasculaire voorvallen, waaronder beroerte, zijn waargenomen in klinische onderzoeken wanneer ESA werd toegediend om hemoglobinewaarden te bereiken die hoger waren dan 12 g / dl (7,5 mmol / l).
Gecontroleerde klinische onderzoeken hebben geen significant voordeel aangetoond dat kan worden toegeschreven aan de toediening van epoëtinen zodra de hemoglobineconcentratie de niveaus heeft overschreden die nodig zijn om de symptomen van bloedarmoede onder controle te houden en bloedtransfusies te voorkomen.
Het hemoglobinegehalte moet met regelmatige tussenpozen worden gemeten totdat het een constante waarde bereikt, en daarna met periodieke tussenpozen. De toename van hemoglobine moet ongeveer 1 g / dl (0,62 mmol / l) per maand zijn en mag niet hoger zijn dan 2 g / dl (1,25 mmol / l) per maand om het risico op het ontwikkelen van hypertensie of de verergering ervan te minimaliseren.
Patiënten met chronisch nierfalen die subcutaan met Retacrit worden behandeld, moeten periodiek worden gecontroleerd op verlies van werkzaamheid, gedefinieerd als non-respons of verminderde respons op behandeling met Retacrit bij patiënten die eerder op een dergelijke therapie reageerden. Dit wordt gekenmerkt door een aanhoudende daling van het hemoglobine ondanks een verhoging van de dosis Retacrit.
Sommige patiënten die worden behandeld met epoëtine alfa met langere doseringsintervallen (meer dan eenmaal per week) behouden mogelijk niet voldoende hemoglobinewaarden (zie rubriek 5.1) en kunnen een dosisverhoging nodig hebben. De hemoglobinespiegels moeten regelmatig worden gecontroleerd.
Voorzichtigheid is geboden bij het verhogen van de doses Retacrit bij patiënten met chronisch nierfalen, aangezien hoge cumulatieve doses epoëtine in verband kunnen worden gebracht met een verhoogd risico op mortaliteit en ernstige cardiovasculaire en cerebrovasculaire voorvallen.Bij patiënten met een slechte hemoglobinerespons op epoëtine, alternatieve verklaringen hiervoor een slechte respons moet worden overwogen (zie rubrieken 4.4 en 5.1).
Een gebrek aan respons op erytropoëtinetherapie moet onmiddellijk de verantwoordelijke factoren onderzoeken. Deze omvatten: ijzer-, folaat- of vitamine B12-tekort, aluminiumintoxicatie, bijkomende infecties, inflammatoire of traumatische episodes, occult bloedverlies, hemolyse, beenmergfibrose van welke oorsprong dan ook.
Gevallen van door antilichamen gemedieerde PRCA zijn zeer zelden gemeld bij patiënten met chronisch nierfalen die subcutaan erytropoëtine kregen toegediend. Bij patiënten die een "plotseling verlies van werkzaamheid vertonen, aangetoond door een afname van hemoglobine (1-2 g / dl per maand) met een verhoogde behoefte aan transfusies, moet een telling van de reticulocyten worden uitgevoerd en typische oorzaken die een respons op de behandeling verhinderen (bijv. , foliumzuur- of vitamine B12-tekort, aluminiumvergiftiging, infectie of ontsteking, bloedverlies, hemolyse) Als er geen oorzaak wordt gevonden, moet worden overwogen om een bloedonderzoek van het beenmerg uit te voeren om een PRCA te diagnosticeren.
Als PRCA wordt gediagnosticeerd, moet de behandeling met Retacrit onmiddellijk worden stopgezet en moet een test op de aanwezigheid van anti-erytropoëtine-antilichamen worden overwogen.Patiënten mogen niet worden omgeleid naar behandeling met een ander geneesmiddel, gezien de kruisreactiviteit tussen anti-erytropoëtine-antilichamen en andere erytropoëtines Andere oorzaken van PRCA moeten worden uitgesloten en een passende therapie moet worden ingesteld.
Periodieke controle van het aantal reticulocyten wordt aanbevolen om verlies van therapeutische werkzaamheid op te sporen bij patiënten met chronisch nierfalen.
Hyperkaliëmie is waargenomen in geïsoleerde gevallen. Bij patiënten met chronisch nierfalen kan correctie van anemie leiden tot een toename van de eetlust en absorptie van kalium en eiwit Voorgeschreven parameters voor dialyse moeten mogelijk periodiek worden aangepast om ureum, creatinine en kalium binnen de gewenste waarden te houden Bij patiënten met chronisch nierfalen serum elektrolyten moeten worden gecontroleerd.Als verhoogde (of stijgende) serumkaliumwaarden worden waargenomen, moet worden overwogen de toediening van erytropoëtine te staken totdat hyperkaliëmie is gecorrigeerd.
Een verhoging van de heparinedosis is vaak nodig tijdens erytropoëtinetherapie vanwege een verhoging van de hematocrietwaarde. Occlusie van het dialysesysteem kan optreden als de heparinisatie niet optimaal is.
Op basis van de tot dusver beschikbare gegevens versnelt correctie van anemie met erytropoëtine bij volwassen patiënten met nierinsufficiëntie die nog geen dialyse ondergaan de progressie van nierinsufficiëntie niet.
Volwassen kankerpatiënten met symptomatische bloedarmoede op chemotherapie
Bij kankerpatiënten die chemotherapie krijgen, moet het interval van 2-3 weken tussen toediening en het verschijnen van door erytropoëtine geïnduceerde erytrocyten in overweging worden genomen bij het beoordelen van de geschiktheid van Retacrit-therapie (patiënten met een risico op transfusie). meer dan 2 g / dl (1,25 mmol / l) per maand of als het niveau 12 g / dl (7,5 mmol / l) overschrijdt, is de procedure voor aanpassing van de dosering zoals aangegeven in rubriek 4.2 zorgvuldig uitgevoerd om de mogelijke risicofactoren voor trombotische voorvallen (zie rubriek 4.2).
Aangezien een verhoogde incidentie van trombo-embolische voorvallen is waargenomen bij kankerpatiënten die behandeld worden met erytropoëtische middelen (zie rubriek 4.8), moet dit risico zorgvuldig worden afgewogen in het licht van het voordeel van behandeling (met Retacrit), vooral bij die kankerpatiënten die een verhoogd trombo-embolisch risico, zoals zwaarlijvige personen of met een voorgeschiedenis van trombotische en vasculaire voorvallen (diepe veneuze trombose, longembolie).
Volwassen patiënten die in aanmerking komen voor een operatie die deel uitmaakt van een autoloog predonatieprogramma
Alle waarschuwingen en speciale voorzorgsmaatregelen die verband houden met autologe predonatieprogramma's moeten in acht worden genomen, vooral door het bloedvolume zoals gewoonlijk te herstellen.
Oncogeen potentieel
Epoëtinen zijn groeifactoren die voornamelijk de aanmaak van erytrocyten stimuleren. Erytropoëtinereceptoren kunnen tot expressie worden gebracht op het oppervlak van een aantal neoplastische cellen. Zoals met alle groeifactoren, bestaat er twijfel dat epoëtine de groei van alle kwaadaardige tumoren kan stimuleren. In verschillende gecontroleerde klinische onderzoeken is dit niet het geval geweest. is aangetoond dat het de algehele overleving verbetert of het risico op kankerprogressie verlaagt bij patiënten met kanker-geassocieerde anemie.
Verschillende gecontroleerde klinische onderzoeken waarbij epoëtinen werden toegediend aan patiënten met een aantal veelvoorkomende maligniteiten, zoals plaveiselcarcinoom van het hoofd-halsgebied, longkanker en borstkanker, hebben een onverklaarbare toename van het sterftecijfer aangetoond. In gecontroleerde klinische onderzoeken toonde het gebruik van epoëtine alfa en andere erytropoëse-stimulerende middelen (ESA's) het volgende aan:
• Een verkorting van de tijd tot tumorprogressie bij patiënten met gevorderde hoofd-halskanker die worden behandeld met radiotherapie bij toediening om hemoglobinewaarden te bereiken die hoger zijn dan 14 g/dl (8,7 mmol/l),
• een afname van de totale overleving en een toename van het aantal sterfgevallen toegeschreven aan tumorprogressie na 4 maanden bij patiënten met uitgezaaide borstkanker die worden behandeld met chemotherapie bij toediening om hemoglobinewaarden van 12-14 g/dl (7,5-8,7 mmol/l) te bereiken ,
• een verhoogd risico op overlijden bij toediening om hemoglobinewaarden van 12 g/dl (7,5 mmol/l) te verkrijgen bij patiënten met actieve maligniteiten die niet worden behandeld met chemotherapie of radiotherapie. Het gebruik van ESA is niet geïndiceerd bij deze patiëntenpopulatie.
Op basis van het bovenstaande moet in sommige klinische aandoeningen bloedtransfusie de voorkeursbehandeling zijn voor de behandeling van anemie bij kankerpatiënten. De beslissing om recombinante erytropoëtines toe te dienen moet gebaseerd zijn op een beoordeling van de baten-risicoverhouding met betrokkenheid van de individuele patiënt en moet rekening houden met de specifieke klinische context. Factoren waarmee bij deze beoordeling rekening moet worden gehouden, zijn onder meer het type kanker en het stadium ervan, de mate van bloedarmoede, de levensverwachting, de omgeving waarin de patiënt wordt behandeld en de voorkeuren van de patiënt (zie paragraaf 5.1).
Dit geneesmiddel bevat fenylalanine, een stof die gevaarlijk kan zijn voor mensen met fenylketonurie.
Dit geneesmiddel bevat minder dan 1 mmol natrium (23 mg) per dosis, wat betekent dat het als "natriumarm" wordt beschouwd.
04.5 Interacties met andere geneesmiddelen en andere vormen van interactie -
Het is niet aangetoond dat behandeling met erytropoëtine het metabolisme van andere geneesmiddelen verandert. Aangezien ciclosporine zich bindt aan erytrocyten, kan er echter een "interactie met andere geneesmiddelen" optreden. Als erytropoëtine gelijktijdig met ciclosporine wordt toegediend, moeten de bloedspiegels van ciclosporine worden gecontroleerd en moet de dosis van dit geneesmiddel worden gecorrigeerd volgens de de stijging van de hematocrietwaarde.
Er is geen bewijs voor een "interactie tussen epoëtine alfa en G-CSF of GM-CSF met betrekking tot hematologische differentiatie of proliferatie in tumorbiopsiemonsters. in vitro.
04.6 Zwangerschap en borstvoeding -
Er zijn geen adequate en goed gecontroleerde onderzoeken bij zwangere vrouwen. Uit dieronderzoek is reproductietoxiciteit gebleken (zie rubriek 5.3). Het is niet bekend of exogeen epoëtine zeta wordt uitgescheiden in de moedermelk.Daarom mag erytropoëtine in het algemeen alleen worden gebruikt tijdens zwangerschap en borstvoeding als de mogelijke voordelen opwegen tegen de mogelijke risico's voor de foetus.
04.7 Beïnvloeding van de rijvaardigheid en het vermogen om machines te bedienen -
Retacrit heeft geen of een verwaarloosbare invloed op de rijvaardigheid of het vermogen om machines te bedienen.
04.8 Bijwerkingen -
Samenvatting van het veiligheidsprofiel
De resultaten van klinische onderzoeken met Retacrit zijn in overeenstemming met het veiligheidsprofiel van andere goedgekeurde erytropoëtines. Op basis van de resultaten van klinische onderzoeken met andere goedgekeurde erytropoëtines, wordt verwacht dat ongeveer 8% van de patiënten die met erytropoëtine worden behandeld bijwerkingen zullen ervaren.Bijwerkingen tijdens de behandeling met erytropoëtine worden voornamelijk waargenomen bij patiënten met chronisch nierfalen of onderliggende maligniteiten en ze zijn voornamelijk vertegenwoordigd door hoofdpijn en een dosisafhankelijke verhoging van de bloeddruk Hypertensieve crises met symptomen die lijken op een "encefalopathie" kunnen optreden. Er moet aandacht worden besteed aan plotselinge acute migraine-achtige hoofdpijn, wat een waarschuwingssignaal kan zijn.
Verstopping van de luchtwegen, waaronder voorvallen van congestie van de bovenste luchtwegen, verstopte neus en nasofaryngitis, is gemeld in sommige onderzoeken bij volwassen patiënten met nierinsufficiëntie die nog geen dialyse ondergaan en die met verlengde doseringsintervallen worden behandeld.
Bij patiënten die met erytropoëtische middelen worden behandeld, zijn trombotische/vasculaire voorvallen zoals myocardischemie, myocardinfarct, cerebrovasculaire accidenten (hersenbloeding en herseninfarct), voorbijgaande ischemische aanvallen, diepe veneuze trombose, arteriële trombose, longembolie, aneurysma, retinale trombose waargenomen stolling in de kunstnier.
Antilichaam-gemedieerde erythroblastopenie (PRCA) is waargenomen na maanden of jaren behandeling met epoëtine alfa. Bij de meeste van deze patiënten zijn antistoffen tegen erytropoëtines waargenomen (zie rubrieken 4.3 en 4.4).
Afdruk van bijwerkingen
Deze rubriek definieert de frequenties van bijwerkingen als: Zeer vaak (> 1/10); vaak (> 1/100 tot 1/1 000 tot 1/10 000 a
Binnen elke frequentieklasse worden bijwerkingen weergegeven in afnemende volgorde van ernst.
De frequentie kan variëren afhankelijk van de indicatie
Volwassen en pediatrische hemodialysepatiënten, volwassen patiënten die peritoneale dialyse ondergaan en volwassen patiënten met nierinsufficiëntie die nog niet gedialyseerd worden
De meest voorkomende bijwerking bij de behandeling met epoëtine alfa is een dosisafhankelijke verhoging van de bloeddruk of verergering van reeds bestaande hypertensie. Deze bloeddrukverhoging kan farmacologisch worden behandeld. Bovendien wordt controle van de bloeddruk aanbevolen. aan het begin van de therapie. De volgende reacties zijn ook opgetreden in geïsoleerde gevallen van patiënten met normale of lage bloeddruk: hypertensieve crisis met symptomen die lijken op encefalopathie (hoofdpijn en verwardheid) en gegeneraliseerde tonicoklonische aanvallen, die onmiddellijk medisch ingrijpen en intensieve behandeling vereisen. tot plotselinge acute migraine-achtige hoofdpijn, wat een waarschuwingssignaal kan zijn.
Shunttrombose kan optreden, vooral bij patiënten met een neiging tot hypotensie of met complicaties van arterioveneuze fistels (stenose, aneurysma's, enz.) Bij deze patiënten wordt een vroege revisie van de shunt en antitrombotische profylaxe, bijvoorbeeld met acetylsalicylzuur, aanbevolen. .
Volwassen kankerpatiënten die chemotherapie krijgen met symptomatische anemie
Hypertensie kan optreden bij patiënten die worden behandeld met epoëtine alfa. Daarom moeten de hemoglobine en bloeddruk nauwlettend worden gecontroleerd.
Een verhoogde incidentie van vasculaire trombotische voorvallen is waargenomen bij patiënten die werden behandeld met erytropoëtische middelen (zie rubriek 4.4 en rubriek 4.8 - Algemene overwegingen).
Patiëntkandidaten voor een operatie
Ongeacht de behandeling met erytropoëtine kunnen trombo-embolische voorvallen optreden na herhaalde aderlaten bij chirurgische patiënten met een onderliggende cardiovasculaire aandoening.
Daarom moeten dergelijke patiënten routinematig een vervanging van het verzamelde bloedvolume ondergaan. Bij patiënten met een hemoglobinegehalte > 13 g/dl bij aanvang kan de mogelijkheid dat behandeling met Retacrit gepaard gaat met een verhoogd risico op postoperatieve trombotische/vasculaire voorvallen niet worden uitgesloten.
Melding van vermoedelijke bijwerkingen
Het melden van vermoedelijke bijwerkingen die optreden na toelating van het geneesmiddel is belangrijk omdat het een continue controle van de baten/risicoverhouding van het geneesmiddel mogelijk maakt.Beroepsbeoefenaren in de gezondheidszorg wordt verzocht alle vermoedelijke bijwerkingen te melden via het nationale meldsysteem.
04.9 Overdosering -
Het therapeutische venster van erytropoëtine is zeer breed.Overdosering van erytropoëtine kan effecten veroorzaken die in het verlengde liggen van de farmacologische effecten van het hormoon. Als er te hoge hemoglobinewaarden optreden, kan een aderlating worden uitgevoerd. Indien nodig moet aanvullende ondersteunende zorg worden verleend.
05.0 FARMACOLOGISCHE EIGENSCHAPPEN -
05.1 "Farmacodynamische eigenschappen -
Farmacotherapeutische categorie: overige anti-anemica, erytropoëtine
ATC-code: B03XA01
Retacrit is een biosimilar. Gedetailleerde informatie is beschikbaar op de website van het Europees Geneesmiddelenbureau http://www.ema.europa.eu
Farmacodynamische effecten
Erytropoëtine is een glycoproteïne dat als mitosestimulerende factor en differentiatiehormoon de productie van erytrocyten uit de voorlopers van het stengelcompartiment stimuleert.Het schijnbare molecuulgewicht van erytropoëtine is 32.000-40.000 dalton. De eiwitfractie van het molecuul vormt ongeveer 58% van het totale molecuulgewicht en bestaat uit 165 aminozuren. De vier koolhydraatketens zijn aan het eiwit gekoppeld door drie N-glycosidebindingen en één oglycosidebinding. Vanuit het oogpunt van de aminozuursequentie en koolhydraatsamenstelling is epoëtine zeta identiek aan endogeen humaan erytropoëtine geïsoleerd uit de urine van anemische patiënten. De biologische werkzaamheid van erytropoëtine is aangetoond in verschillende diermodellen in vivo (normale en anemische ratten, polycythemische muizen). Na toediening van erytropoëtine nemen het aantal erytrocyten, hemoglobinewaarden en het aantal reticulocyten toe samen met de opnamesnelheid van 59Fe. in tests in vitro (muizenmiltcelkweek), werd een verhoogde opname van 3H-thymidine in genucleëerde erytroïde cellen van de milt waargenomen na incubatie met erytropoëtine.
Door celculturen van menselijk beenmerg is aangetoond dat erytropoëtine specifiek erytropoëse stimuleert zonder de leukopoëse te veranderen. Er werd geen cytotoxische activiteit van erytropoëtine waargenomen op beenmergcellen.
Net als bij andere hematopoëtische groeifactoren is erytropoëtine aangetoond in vitro om stimulerende eigenschappen van menselijke endotheelcellen te bezitten.
Volwassen patiënten met nierinsufficiëntie die nog geen dialyse ondergaan
In 2 onderzoeken met verlengde doseringsintervallen van erytropoëtine (3 keer per week, eenmaal per week, eenmaal per 2 weken en eenmaal per 4 weken) handhaafden sommige patiënten met langere doseringsbereiken geen adequate hemoglobinewaarden en de protocolvereisten voor stopzetting gedefinieerd door de hemoglobine waarde wordt bereikt (0% bij dosering eenmaal per week, 3,7% bij dosering eenmaal per twee weken en 3,3% in groepen eenmaal per 4 weken).
Klinische werkzaamheid en veiligheid
Bij drie placebogecontroleerde onderzoeken waren 721 kankerpatiënten betrokken die platinavrije chemotherapie kregen, waaronder 389 met hematologische maligniteiten (221 met multipel myeloom, 144 met non-Hodgkin-lymfoom en 24 met andere hematologische maligniteiten) en 332 met solide tumoren (172 borstklieren, 64 gynaecologische , 23 long, 22 prostaat, 21 gastro-intestinaal en 30 andere). Bij twee grote open-label onderzoeken waren 2 697 kankerpatiënten betrokken die platinavrije chemotherapie kregen, waaronder 1 895 met solide tumoren (683 borst-, 260 long-, 174 gynaecologische, 300 gastro-intestinale en 478 overige) en 802 met hematologische maligniteiten.
In een prospectieve, gerandomiseerde, dubbelblinde, placebogecontroleerde studie uitgevoerd bij 375 anemische patiënten met verschillende niet-myeloïde neoplasmata en die platinavrije chemotherapie kregen, werd een significante vermindering van de gevolgen geassocieerd met anemie (zoals vermoeidheid, asthenie en verminderde activiteit) ), gemeten met de volgende beoordelingsinstrumenten: de algemene beoordelingsschaal FACT-An (Functional Assessment of Cancer Therapy-Anemie), de vermoeidheidsbeoordelingsschaal FACT-An en de Cancer Linear Analogue Scale (CLAS). Twee andere gerandomiseerde, placebogecontroleerde onderzoeken waarbij minder patiënten betrokken waren, lieten geen significante verbetering zien in de parameters voor kwaliteit van leven die werden beoordeeld met respectievelijk de EORTC-QLQ-C30-schaal en CLAS.
Erytropoëtine is een groeifactor die voornamelijk de aanmaak van erytrocyten stimuleert Erytropoëtinereceptoren kunnen tot expressie worden gebracht op het oppervlak van verschillende soorten tumorcellen.
Overleving en tumorprogressie werden geanalyseerd in vijf grote gecontroleerde onderzoeken, waaraan in totaal 2.833 patiënten deelnamen, waaronder vier dubbelblinde, placebogecontroleerde onderzoeken en één open-label onderzoek. In deze onderzoeken werden patiënten opgenomen die chemotherapie kregen (twee onderzoeken) of patiëntenpopulaties bij wie erytropoësestimulerende middelen niet zijn geïndiceerd: kankerpatiënten met anemie die geen chemotherapie ondergaan en patiënten met hoofd-halskanker die radiotherapie ondergaan. concentratie was> 13 g / dl; in de overige onderzoeken was het 12-14 g / dl. In het open-label onderzoek werd geen verschil in algehele overleving gevonden tussen patiënten behandeld met recombinant humaan erytropoëtine versus controles. In de vier placebo- gecontroleerde studies, de hazard ratio (gevarenverhouding:) voor totale overleving was tussen 1,25 en 2,47, in het voordeel van controles. In vergelijking met controles werd in deze onderzoeken een statistisch significante, constante en onverklaarbare toename van de mortaliteit waargenomen bij patiënten met anemie die gepaard ging met verschillende veelvoorkomende maligniteiten en die werden behandeld met recombinant humaan erytropoëtine. De algehele overlevingsresultaten van de onderzoeken konden niet bevredigend worden verklaard door de verschillen in de incidentie van trombose en bijbehorende complicaties bij proefpersonen die werden behandeld met recombinant humaan erytropoëtine en bij controlepersonen.
Er werd ook een systematische review uitgevoerd bij meer dan 9.000 kankerpatiënten die deelnamen aan 57 klinische onderzoeken. Meta-analyse van gegevens over de totale overleving leverde een geschatte hazard ratio van 1,08 op in het voordeel van controles (95% BI: 0,99; 1,18; 42 onderzoeken en 8 167 patiënten). Een verhoogd relatief risico op trombo-embolische voorvallen werd waargenomen bij patiënten die werden behandeld met recombinant humaan erytropoëtine (RR 1,67, 95% BI: 1,35, 2,06, 35 onderzoeken en 6 769 patiënten). Er is een verhoogd risico op trombo-embolische voorvallen bij kankerpatiënten die worden behandeld met recombinant humaan erytropoëtine en een negatief effect op de algehele overleving kan niet worden uitgesloten. Het is niet bekend in hoeverre deze gegevens kunnen worden toegeschreven aan de toediening van recombinant humaan erytropoëtine aan kankerpatiënten die chemotherapie krijgen om hemoglobineconcentraties van minder dan 13 g/dl te bereiken, aangezien slechts enkele patiënten met de beschreven kenmerken in de beoordeelde gegevens werden opgenomen.
Er werd ook een analyse van gegevens van een enkele patiënt uitgevoerd op meer dan 13.900 kankerpatiënten (chemo-radio-, chemoradium- of geen therapie) die deelnamen aan 53 gecontroleerde klinische onderzoeken met verschillende epoëtines. De totale overleving genereerde een hazard ratio-puntschatting van 1,06 in het voordeel van controles (95% BI: 1,00; 1,12: 53 onderzoeken en 13 933 patiënten) en voor kankerpatiënten die chemotherapie kregen, was de totale overlevingsrisicoratio 1,04 (95% BI: 0,97; 1,11; 38 onderzoeken en 10 441 patiënten). -analyse ondersteunt ook een consistent en significant verhoogd relatief risico op trombo-embolische voorvallen bij kankerpatiënten die worden behandeld met recombinant humaan erytropoëtine (zie rubriek 4.4).
In een gerandomiseerde, dubbelblinde, placebo-gecontroleerde studie van 4.038 niet-gedialyseerde CRF-patiënten met type 2-diabetes en hemoglobinewaarden ≤ 11 g/dl, werden patiënten behandeld met ofwel darbepoetin alfa om hemoglobinewaarden van 13 g/dl te bereiken of placebo (zie rubriek 4.4).De studie voldeed niet aan een van de primaire doelstellingen door aan te tonen dat het risico op gerelateerde mortaliteit, cardiovasculaire morbiditeit en ontwikkeling van terminale nierziekte (ESRD) werd verminderd. Analyses van de afzonderlijke componenten van de samengestelde eindpunten lieten een HR zien ( 95% BI): overlijden 1,05 (0,92, 1,21), beroerte 1,92 (1,38, 2,68), congestief hartfalen (CHF) 0,89 (0,74, 1,08), myocardinfarct (MI) 0,96 (0,75, 1,23), ziekenhuisopname voor myocardischemie 0,84 ( 0,55, 1,27), ESRD 1,02 (0,87, 1,18).
Gepoolde analyses van post-hocgegevens uit klinische onderzoeken met ESA die zijn uitgevoerd bij patiënten met CRF (die dialyse ondergaan, niet dialyse, met of zonder diabetes). Er was een trend naar toenemende risicoschattingen voor mortaliteit door alle oorzaken en cardiovasculaire en cerebrovasculaire voorvallen geassocieerd met de hoogste cumulatieve doses ESA, ongeacht de diabetes- of dialysestatus (zie rubrieken 4.2 en 4.4).
05.2 "Farmacokinetische eigenschappen -
Intraveneuze toedieningsweg
Meting van erytropoëtine na herhaalde intraveneuze toediening toonde een "halfwaardetijd van ongeveer 4 uur bij gezonde vrijwilligers en een" iets langere halfwaardetijd bij patiënten met nierinsufficiëntie (ongeveer 5 uur). Bij kinderen is een halfwaardetijd van ongeveer 6 uur gemeld.
Wijze van subcutane toediening
Na subcutane injectie zijn de serumerytropoëtinespiegels veel lager dan de intraveneuze spiegels, nemen langzaam toe en pieken tussen 12 en 18 uur na toediening. Deze piek ligt altijd ruim onder de intraveneuze piek (ongeveer 1/20).
Er zijn geen accumulatieverschijnselen: de concentraties blijven hetzelfde, of ze nu 24 uur na de eerste injectie of 24 uur na de laatste injectie worden gedetecteerd.
De halfwaardetijd is moeilijk vast te stellen bij subcutane toediening en wordt geschat op ongeveer 24 uur De biologische beschikbaarheid van subcutaan injecteerbaar erytropoëtine is veel lager dan het intraveneuze geneesmiddel: ongeveer 20%.
05.3 Gegevens uit het preklinisch veiligheidsonderzoek -
In sommige preklinische toxicologische onderzoeken bij honden en ratten, maar niet bij apen, is behandeling met erytropoëtine in verband gebracht met subklinische beenmergfibrose (beenmergfibrose is een bekende complicatie van chronisch nierfalen bij mensen en kan verband houden met secundaire hyperparathyreoïdie of onbekende factoren). . In een studie uitgevoerd bij hemodialysepatiënten die gedurende 3 jaar met erytropoëtine werden behandeld, was de incidentie van beenmergfibrose niet verhoogd in vergelijking met een overeenkomstige groep controlepatiënten die dialyse ondergingen maar niet werden behandeld met erytropoëtine.
Dierstudies hebben aangetoond dat erytropoëtine het lichaamsgewicht van de foetus verlaagt, het ossificatieproces vertraagt en de foetale mortaliteit verhoogt bij wekelijkse doses die ongeveer 20 maal hoger zijn dan die voor mensen worden aanbevolen. Deze veranderingen worden geïnterpreteerd als secundair aan de verminderde toename van het lichaamsgewicht van de moeder.
Erytropoëtine vertoonde geen activiteit in mutageniteitstesten op celculturen van bacteriën en zoogdieren en in vivo in een micronucleus-test bij muizen. Er zijn geen carcinogeniteitsonderzoeken op lange termijn uitgevoerd. Er zijn tegenstrijdige gegevens in de literatuur over de mogelijkheid dat erytropoëtine een belangrijke rol speelt bij de proliferatie van kankercellen. Deze gegevens zijn gebaseerd op verkregen resultaten in vitro van menselijke tumorweefselmonsters; hun reikwijdte in de klinische setting is echter onduidelijk.
06.0 FARMACEUTISCHE INFORMATIE -
06.1 Hulpstoffen -
Dinatriumfosfaatdihydraat
Natriummonobasisch fosfaatdihydraat
Natriumchloride
Calciumchloride dihydraat
Polysorbaat 20
Glycine
Leucine
isoleucine
Threonine
Glutaminezuur
fenylalanine
Water voor injecteerbare oplossingen
Natriumhydroxide (om de pH aan te passen)
Zoutzuur (om de pH aan te passen)
06.2 Incompatibiliteit "-
Bij gebrek aan onderzoek naar onverenigbaarheden, mag dit geneesmiddel niet met andere producten worden gemengd.
06.3 Geldigheidsduur "-
30 maanden
06.4 Speciale voorzorgsmaatregelen bij bewaren -
Bewaren in de koelkast (2 ° C - 8 ° C). Niet bevriezen.
Bewaar de voorgevulde spuit in de buitenverpakking om het geneesmiddel tegen licht te beschermen.
Tijdens poliklinisch gebruik kan de patiënt het product uit de koelkast halen en bewaren bij kamertemperatuur (beneden 25°C) gedurende een enkele periode van maximaal 3 dagen.
06.5 Aard van de primaire verpakking en inhoud van de verpakking -
0,3 ml oplossing in type I glazen voorgevulde spuit met vaste stalen naald en met PTFE beklede zuigerstop met of zonder naaldbeschermer.
Een verpakking bevat 1 of 6 voorgevulde spuiten.
Mogelijk worden niet alle verpakkingsgrootten in de handel gebracht.
06.6 Instructies voor gebruik en verwerking -
Instructies voor het hanteren van Retacrit:
1. Nadat u een spuit uit de blisterverpakking heeft gehaald, controleert u of de oplossing helder, kleurloos en praktisch vrij is van zichtbare deeltjes.
2. Verwijder de naaldbeschermer en knijp de lucht uit de naald en spuit door de spuit rechtop te houden en de zuiger voorzichtig omhoog te duwen.
3. De spuit is klaar voor gebruik.
Retacrit mag niet worden gebruikt als een van de volgende situaties zich voordoet:
• de blister is open of anderszins beschadigd;
• de oplossing is niet kleurloos of bevat zichtbare deeltjes in suspensie;
• c "Er is vloeistof uit de voorgevulde spuit gelekt of er is condensatie zichtbaar in de blister die nog steeds is verzegeld;
• het geneesmiddel is per ongeluk ingevroren.
Dit geneesmiddel is uitsluitend bedoeld voor eenmalig gebruik.
Schud niet.
Ongebruikte medicijnen en afval afkomstig van dit medicijn moeten worden weggegooid in overeenstemming met de lokale regelgeving.
07.0 HOUDER VAN DE "VERGUNNING VOOR HET IN DE HANDEL BRENGEN" -
Hospira UK Limited
Horizon
Honey Lane
Hurley
maagdenkop
SL6 6RJ
VK
08.0 NUMMER VAN DE VERGUNNING VOOR HET IN DE HANDEL BRENGEN -
EU / 1/07/431/001 voorgevulde spuit
EU / 1/07/431/002 voorgevulde spuit
EU / 1/07/431/026 voorgevulde spuit met naaldbeschermer
EU / 1/07/431/027 voorgevulde spuit met naaldbeschermer
038381012
038381024
038381265
038381277
09.0 DATUM VAN EERSTE VERGUNNING OF VERLENGING VAN DE VERGUNNING -
Datum eerste vergunning: 18 december 2007
Datum van laatste verlenging: 15 november 2012
10.0 DATUM VAN HERZIENING VAN DE TEKST -
D.CCE september 2016
11.0 VOOR RADIOPharmaceuticals, VOLLEDIGE GEGEVENS OVER DE INTERNE STRALINGSDOSIMETRIE -
12.0 VOOR RADIODRUGS, VERDERE INSTRUCTIES VOOR UITSLUITENDE VOORBEREIDING EN KWALITEITSCONTROLE -