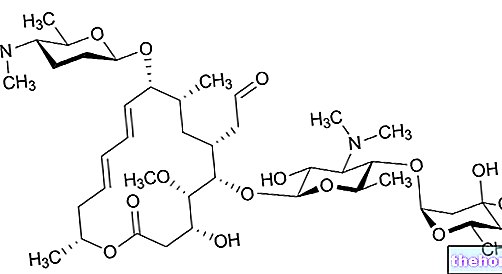
Actieve ingrediënten: Methotrexaat
METHOTREXAAT 50 mg poeder voor oplossing voor injectie
METHOTREXAAT 500 mg poeder voor oplossing voor injectie
METHOTREXAAT 1 g poeder voor oplossing voor injectie
METHOTREXAAT 50 mg / 2 ml oplossing voor injectie
METHOTREXAAT 500 mg / 20 ml oplossing voor injectie
METHOTREXAAT 1 g / 10 ml oplossing voor injectie
METHOTREXAAT 5 g / 50 ml oplossing voor injectie
Bijsluiters van methotrexaat zijn beschikbaar voor verpakkingsgrootten: - METHOTREXATE 50 mg poeder voor oplossing voor injectie, METHOTREXATE 500 mg poeder voor oplossing voor injectie, METHOTREXATE 1 g poeder voor oplossing voor injectie, METHOTREXATE 50 mg/2 ml oplossing voor injectie, METHOTREXATE 500 mg/20 ml oplossing voor injectie, METHOTREXATE 1 g / 10 ml oplossing voor injectie , METHOTREXATE 5 g / 50 ml oplossing voor injectie
- METHOTREXATE 2,5 mg tabletten, METHOTREXATE 5 mg poeder voor oplossing voor injectie, METHOTREXATE 7,5 mg/ml oplossing voor injectie, METHOTREXATE 10 mg/1,33 ml oplossing voor injectie, METHOTREXATE 15 mg/2 ml oplossing voor injectie, METHOTREXATE 20 mg/2, 66 ml oplossing voor injectie.
Waarom wordt Methotrexaat gebruikt? Waar is het voor?
FARMACOTHERAPEUTISCHE CATEGORIE
antineoplastisch.
THERAPEUTISCHE INDICATIES
Methotrexaat is geïndiceerd voor de antineoplastische chemotherapiebehandeling van de volgende vormen: borstcarcinoom, choriocarcinoom en soortgelijke trofoblastische ziekten, acute en subacute lymfatische en meningeale leukemie, lymfosarcoom, mycosis fungoides.
Klinisch onderzoek heeft aangetoond dat het aanzienlijk effectiever is bij leukemie bij kinderen dan bij leukemie bij volwassenen.In sommige gevallen van acute leukemie heeft het klinische verbetering en verlengde overlevingstijd veroorzaakt voor een periode van enkele weken tot 2 jaar.Het hematologische beeld, verkregen door bloedonderzoek en beenmerguitstrijkjes na toediening van methotrexaat, kan gedurende variabele perioden bijna niet meer van normaal te onderscheiden zijn. De beste effecten werden waargenomen bij acute leukemieën die worden gekenmerkt door de aanwezigheid van zeer onrijpe vormen in het beenmerg en het bloed. Er zijn gunstige resultaten gemeld die zijn verkregen met methotrexaat bij choriocarcinoom.
Methotrexaat is met name geïndiceerd bij mono- of polychemotherapie voor de behandeling van: osteogeen sarcoom, acute leukemie, bronchogeen carcinoom, epidermoïde carcinoom van het hoofd en de nek.
Contra-indicaties Wanneer methotrexaat niet mag worden gebruikt
Overgevoeligheid voor de werkzame stof of voor één van de hulpstoffen.
Methotrexaat is gecontra-indiceerd tijdens de zwangerschap.
Het gebruik ervan kan teratogene effecten, foetale dood, embryotoxiciteit en abortus veroorzaken bij toediening aan zwangere vrouwen. Bij de behandeling van neoplastische ziekten mag het alleen worden gebruikt als de mogelijke voordelen opwegen tegen het risico voor de foetus.
Vrouwen in de vruchtbare leeftijd mogen geen behandeling met methotrexaat starten totdat zwangerschap is uitgesloten; zij moeten volledig worden geïnformeerd over de ernstige risico's voor de foetus als zwangerschap optreedt tijdens de behandeling met methotrexaat. Als een van beide partners wordt behandeld met methotrexaat, moet zwangerschap worden vermeden. Het optimale tijdsinterval tussen het einde van de behandeling met Methotrexaat door beide partners en het zwanger worden is nog niet duidelijk vastgesteld (zie "Speciale waarschuwingen"). De aanbevelingen met betrekking tot de tijdsintervallen, ontleend aan de gepubliceerde literatuur, variëren van 3 maanden tot een jaar.
Methotrexaat wordt aangetroffen in moedermelk. Methotrexaat is gecontra-indiceerd bij vrouwen die borstvoeding geven vanwege het potentieel om ernstige bijwerkingen bij de zuigeling te veroorzaken.
De hoogste verhouding van methotrexaatconcentraties in moedermelk tot plasma was 0,08:1. Methotrexaatformuleringen en verdunningsmiddelen die conserveermiddelen bevatten, mogen niet worden gebruikt voor intrathecale toediening of voor behandeling met hoge doses methotrexaat.
Ernstige nierinsufficiëntie
Voorzorgen bij gebruik Wat u moet weten voordat u Methotrexaat inneemt
Methotrexaat kan ernstige toxische reacties veroorzaken, meestal gerelateerd aan de dosering.
Patiënten die een behandeling met methotrexaat ondergaan, moeten nauwlettend worden gecontroleerd om de tekenen en symptomen van mogelijke toxische effecten of bijwerkingen zo snel mogelijk te identificeren en te evalueren. Een controle voorafgaand aan de behandeling en periodieke hematologische controles zijn noodzakelijk voor het gebruik van Methotrexaat bij chemotherapie, vanwege het mogelijke onderdrukkende effect op de hematopoëtische functie dat aan het geneesmiddel kan worden toegeschreven.
Het kan op elk moment plotseling optreden en zelfs in lage doses.
Elke scherpe daling van het aantal bloedcellen geeft aan dat de toediening van het geneesmiddel onmiddellijk moet worden gestaakt en dat de juiste therapie moet worden ingesteld.Bij patiënten met kanker en reeds bestaande beenmergaplasie, leukopenie, trombocytopenie of anemie, moet het product met voorzichtigheid worden gebruikt en alleen als strikt Methotrexaat wordt voornamelijk via de nieren uitgescheiden Behandeling met methotrexaat bij patiënten met nierinsufficiëntie dient met uiterste voorzichtigheid en met verlaagde doseringsschema's te worden uitgevoerd, aangezien een verminderde nierfunctie de eliminatie van methotrexaat vermindert. In aanwezigheid van een gestoorde nierfunctie moet methotrexaat met uiterste voorzichtigheid en in een lagere dosering worden ingenomen, omdat een verminderde nierfunctie resulteert in een vertraagde eliminatie van methotrexaat. De nierfunctie van de patiënt moet voor en tijdens de behandeling met methotrexaat met grote voorzichtigheid worden bepaald als ernstige nierinsufficiëntie wordt gevonden. In dit geval moet de dosering worden verlaagd of het medicijn worden geschorst totdat de nierfunctie verbetert.
Methotrexaat veroorzaakt hepatotoxiciteit, leverfibrose en cirrose, maar over het algemeen alleen na langdurig gebruik.
Acute stijgingen van leverenzymen zijn vaak waargenomen; deze zijn meestal van voorbijgaande aard en asymptomatisch en lijken ook geen volgende leverziekte te voorspellen. Na langdurig gebruik vertoont leverbiopsie vaak histologische veranderingen en zijn fibrose en cirrose gemeld; dit laatste mag ook niet voorafgegaan worden door symptomen of abnormale leverfunctietesten bij de psoriasispopulatie.
Periodieke leverbiopten worden over het algemeen aanbevolen voor psoriasispatiënten die langdurig worden behandeld. Aanhoudende afwijkingen in leverfunctietesten kunnen voorafgaan aan het ontstaan van fibrose of cirrose bij de populatie reumatoïde artritis.
Methotrexaat zorgde ervoor dat de hepatitis B-infectie opnieuw werd geactiveerd of de hepatitis C-infectie verergerde, in sommige gevallen met de dood tot gevolg. Sommige gevallen van hepatitis B-reactivering zijn opgetreden na stopzetting van methotrexaat. Klinische en laboratoriumevaluaties dienen te worden uitgevoerd om een reeds bestaande leverziekte te evalueren bij patiënten met eerdere infecties met hepatitis B en C. Op basis van deze evaluaties is het mogelijk dat behandeling met methotrexaat voor sommige patiënten niet geïndiceerd is.
Bloedingstijd, stollingstijd en bloedgroepbepaling dienen te gebeuren vóór een transfusie of operatie.
Methotrexaat moet worden toegediend onder persoonlijk en nauwlettend toezicht van de arts, die de patiënt niet in één keer grotere hoeveelheden mag voorschrijven dan de dosering die nodig is voor 6-7 dagen therapie. Er moet wekelijks een volledige bloedtelling worden uitgevoerd. De dosering moet worden stopgezet of de dosering moet worden verlaagd onmiddellijk nadat de eerste tekenen van ulceratie, bloeding, diarree of significante depressie verschijnen.
Patiënten met reumatoïde artritis lopen het risico longziekte van reumatoïde artritis te ontwikkelen, vaak geassocieerd met interstitiële longziekte.
Methotrexaat heeft, net als de meeste geneesmiddelen tegen kanker en immunosuppressiva, onder bepaalde experimentele omstandigheden kankerverwekkende eigenschappen bij dieren aangetoond. Methotrexaat mag alleen worden gebruikt door artsen die ervaring hebben op het gebied van antimetabolieten.
Patiënten moeten worden geïnformeerd over de mogelijke risico's en voordelen van het gebruik van methotrexaat (inclusief de eerste symptomen en tekenen van toxiciteit), de noodzaak om hun arts zo nodig snel te raadplegen en de noodzaak van een nauwgezette follow-up, waaronder medische tests. toxiciteit De risico's van effecten op het reproductievermogen moeten worden besproken met patiënten, zowel vrouwen als mannen, die worden behandeld met methotrexaat.
Toestanden van folaatdeficiëntie kunnen de toxiciteit van methotrexaat verhogen
verdraagbaarheid
Maagdarmstelsel
Als braken, diarree of stomatitis resulterend in uitdroging optreden, moet ondersteunende therapie worden ingesteld en moet methotrexaat worden gestaakt totdat de symptomen zijn verdwenen.
Bloedsysteem
Methotrexaat kan hematopoëse onderdrukken en bloedarmoede, aplastische anemie, pancytopenie, leukopenie, neutropenie en/of trombocytopenie veroorzaken Methotrexaat moet met voorzichtigheid worden gebruikt bij patiënten met een reeds bestaande hematopoëtische deficiëntie (zie rubriek 4.5). bloedplaatjes wordt doorgaans 5-13 dagen na toediening van een IV-bolusdosis bereikt (met herstel na 14-28 dagen) Leukocyten en neutrofielen kunnen soms twee verlagingen vertonen: de eerste na 4-7 dagen en het tweede dieptepunt na 12-21 dagen , met daaropvolgend herstel Klinische gevolgen zoals koorts, infectie en bloeding op verschillende plaatsen kunnen optreden Bij de behandeling van maligniteiten mag methotrexaat alleen worden voortgezet als de mogelijke voordelen opwegen tegen het risico op ernstige myelosuppressie Bij psoriasis en reumatoïde artritis dient methotrexaat onmiddellijk gestopt in het geval van een significante daling van het bloedbeeld. van bloedcellen.
Leversysteem
Methotrexaat veroorzaakt acute hepatitis en chronische hepatotoxiciteit (fibrose en cirrose). Chronische toxiciteit is levensbedreigend en is in het algemeen opgetreden na langdurig gebruik (meestal 2 jaar of langer) en na een cumulatieve cumulatieve dosis van ten minste 1,5 gram In onderzoeken bij patiënten met psoriasis lijkt hepatotoxiciteit een functie te zijn van de totale cumulatieve dosis en lijkt te worden verhoogd door alcoholisme, obesitas, diabetes en ouderdom. Voorbijgaande afwijkingen van leverparameters worden vaak waargenomen na toediening van methotrexaat en vormen meestal geen reden om de behandeling aan te passen. Aanhoudende leverafwijkingen en/of verlagingen van serumalbumine kunnen wijzen op ernstige levertoxiciteit.
Bij psoriasis dienen leverfunctie- en leverbeschadigingstests, waaronder serumalbuminemeting en protrombinetijd, herhaaldelijk vóór toediening te worden uitgevoerd.Leverfunctietestwaarden zijn vaak normaal tijdens de ontwikkeling van fibrose of cirrose.
Deze laesies kunnen alleen worden opgespoord met een biopsie. Leverbiopsie wordt aanbevolen:
- voor aanvang van de behandeling of direct na aanvang van de therapie (2-4 maanden);
- bij het bereiken van een cumulatieve totale dosis van 1,5 g;
- na elke extra dosis van 1,0 tot 1,5 g.
In geval van matige fibrose of enige vorm van cirrose, stop de behandeling. Voor milde fibrose wordt meestal voorgesteld om de biopsie na 6 maanden te herhalen. Mildere histologische veranderingen zoals leververvetting en laaggradige poortontsteking komen relatief vaak voor voordat met de behandeling wordt begonnen. Hoewel deze kleine veranderingen gewoonlijk geen reden zijn om de behandeling met methotrexaat te staken of niet voor te schrijven, dient het geneesmiddel met voorzichtigheid te worden gebruikt.
Bij reumatoïde artritis zijn de leeftijd van de patiënt op het moment van de eerste toediening van methotrexaat en de duur van de behandeling gemeld als risicofactoren voor hepatotoxiciteit. Aanhoudende afwijkingen in leverfunctietesten kunnen voorafgaan aan het ontstaan van fibrose of cirrose bij de populatie reumatoïde artritis. Bij patiënten met reumatoïde artritis die worden behandeld met methotrexaat, moeten leverfunctietests worden uitgevoerd bij aanvang en met tussenpozen van 4-8 weken.
Bij patiënten met een voorgeschiedenis van overmatig alcoholgebruik moet vóór de behandeling een leverbiopsie worden uitgevoerd; Uitgangswaarden van aanhoudend abnormale leverfunctietesten of chronische hepatitis type B of C. Tijdens de therapie moet een leverbiopsie worden uitgevoerd in geval van aanhoudende leverfunctietestafwijkingen of als serumalbuminespiegels onder de normale waarden dalen (in de " context van een" goed gecontroleerde reumatoïde artritis).
Als de resultaten van de leverbiopsie lichte veranderingen laten zien (Roenigk-schaal I, II, IIIa), kan de behandeling met methotrexaat worden voortgezet door de patiënt te volgen volgens de bovenstaande aanbevelingen. De behandeling met methotrexaat moet worden stopgezet bij alle patiënten die aanhoudende afwijkingen in de leverfunctietest vertonen en weigeren een leverbiopsie te ondergaan, en bij alle patiënten bij wie een leverbiopsie matige tot ernstige veranderingen vertoont (Roenigk IIIb-schaal of IV).
Immunologische toestanden
Methotrexaat moet met uiterste voorzichtigheid worden gebruikt bij actieve infecties en is over het algemeen gecontra-indiceerd bij patiënten met manifeste of laboratorium-aangetoonde immunodeficiëntiesyndromen.
Immunisatie
Vaccinaties kunnen minder immunogeen zijn tijdens de behandeling met methotrexaat. Vaccinatie met levende virusvaccins wordt over het algemeen niet aanbevolen.Er zijn meldingen geweest van gedissemineerde vaccininfectie na immunisatie met het pokkenvirus bij patiënten die methotrexaat kregen.
infecties
Er kan longontsteking optreden (wat in sommige gevallen kan leiden tot ademhalingsfalen). Levensbedreigende opportunistische infecties, met name Pneumocystis carinii-pneumonie, kunnen optreden bij behandeling met methotrexaat. Wanneer een patiënt longsymptomen vertoont, moet altijd rekening worden gehouden met de mogelijkheid van Penumocystis carinii-pneumonie.
Zenuwstelsel
Gevallen van leuko-encefalopathie zijn gemeld na intraveneuze toediening van methotrexaat bij patiënten die craniospinale bestraling ondergaan. Ernstige neurotoxiciteit, die zich vaak manifesteert als focale of gegeneraliseerde aanvallen, is gemeld met een onverwacht verhoogde frequentie bij pediatrische patiënten met acute lymfatische leukemie die werden behandeld met intermediaire doses methotrexaat intraveneus toegediend (1 g/m2). Bij symptomatische patiënten werden vaak micro-angiopathische leuko-encefalopathie en/of calcificaties waargenomen in onderzoeken met diagnostische beeldvormingsmethoden. Chronische leuko-encefalopathie is ook gemeld bij patiënten die herhaaldelijk hoge doses methotrexaat hebben gekregen met calciumfolinaat-rescue, zelfs zonder bestraling van de schedel. Er zijn ook gevallen van leuko-encefalopathie geweest bij patiënten die oraal methotrexaat kregen. Stoppen met methotrexaat leidt niet altijd tot volledig herstel.
Een voorbijgaand acuut neurologisch syndroom is waargenomen bij patiënten die werden behandeld met regimes met hoge doses. Manifestaties van dit neurologische syndroom kunnen gedragsafwijkingen, focale sensomotorische tekenen, waaronder voorbijgaande blindheid, en abnormale reflexen omvatten. De exacte oorzaak is niet bekend. Na intrathecaal gebruik van methotrexaat kan de toxiciteit die kan optreden in het centrale zenuwstelsel als volgt worden ingedeeld: acute chemische arachnoïditis die zich manifesteert met symptomen zoals hoofdpijn, rugpijn, nekstijfheid en koorts; subacute myelopathie die wordt gekenmerkt door bijv. paraparese/paraplegie geassocieerd met betrokkenheid van een of meer spinale zenuwwortels chronische leuko-encefalopathie die zich bijvoorbeeld manifesteert met verwardheid, prikkelbaarheid, slaperigheid, ataxie, dementie, toevallen en coma centraal zenuwstelsel kan progressief en zelfs fataal zijn Bestraling van de schedel in combinatie met intrathecale toediening van methotrexaat heeft aangetoond dat de incidentie van leuko-encefalopathie verhogen Tekenen van neurotoxiciteit (meningeale irritatie, permanente of voorbijgaande parese, encefalopathie) moeten worden gecontroleerd na intrathecale toediening van methotrexaat.
Intrathecale en intraveneuze toediening van methotrexaat kan acute encefalitis en acute encefalopathie veroorzaken met fatale afloop.
Er zijn meldingen geweest van patiënten met periventriculair lymfoom van het centrale zenuwstelsel die hersenhernia ontwikkelden bij intrathecale toediening van methotrexaat.
Gevallen van ernstige neurologische bijwerkingen variërend van hoofdpijn tot verlamming, coma en beroerte-achtige episodes zijn voornamelijk gemeld bij jonge mensen en adolescenten die methotrexaat in combinatie met cytarabine kregen.
Ademhalingssysteem
Pulmonale tekenen en symptomen, zoals droge, niet-productieve hoest, koorts, hoesten, pijn op de borst, dyspneu, hypoxemie en röntgeninfiltraat van de thorax, of niet-specifieke pneumonie die optreedt tijdens de behandeling met methotrexaat, kunnen wijzen op mogelijk schadelijk letsel en het stopzetten van de behandeling en zorgvuldige controle Longlaesies kunnen bij elke dosering optreden Infectie (inclusief pneumonie) moet worden uitgesloten.
Longfunctietesten kunnen nuttig zijn als longziekte wordt vermoed, vooral als er baselinegegevens beschikbaar zijn.
urinestelsel
Methotrexaat kan nierbeschadiging veroorzaken, wat kan leiden tot acuut nierfalen. Het wordt aanbevolen om uiterste aandacht te besteden aan de nierfunctie, waaronder voldoende hydratatie, alkalisering van de urine, dosering van methotrexata en evaluatie van de nierfunctie.
Indien mogelijk moet gelijktijdig gebruik van protonpompremmers (PPI's) en hoge doses methotrexaat worden vermeden en moet voorzichtigheid worden betracht bij patiënten met nierinsufficiëntie.
Huid
Ernstige, soms fatale huidreacties, zoals het Stevens-Johnson-syndroom, toxische epidermale necrolyse (syndroom van Lyell) en erythema multiforme, zijn gemeld na enkelvoudige of meervoudige doses methotrexaat.
Reacties traden op binnen een periode van dagen na orale, intramusculaire, intraveneuze of intrathecale toediening van methotrexaat. Genezing werd gemeld bij stopzetting van de behandeling
Laboratorium testen
Algemeen
Patiënten die met methotrexaat worden behandeld, moeten zorgvuldig worden gecontroleerd om eventuele toxische effecten onmiddellijk te detecteren.
Voor een juiste klinische evaluatie van patiënten die een behandeling met methotrexaat ondergaan of ondergaan, moeten de volgende laboratoriumtests worden uitgevoerd: volledig bloedbeeld met aantal bloedplaatjes, hematocriet, urineonderzoek, nierfunctietest en leverfunctietest, "Hepatitis B- en hepatitis C-infectie. A Er moet ook een thoraxfoto worden gemaakt. Het doel van deze tests is om de aanwezigheid van eventuele disfuncties vast te stellen en het is noodzakelijk om deze uit te voeren voor, tijdens en aan het einde van de therapie. Frequentere controle kan ook geïndiceerd zijn aan het begin van de therapie of wanneer de dosering wordt gewijzigd, of tijdens perioden met een verhoogd risico op hoge bloedspiegels van methotrexaat (bijv. dehydratie). Volledige bloedtellingen moeten dagelijks worden uitgevoerd gedurende de eerste maand van de therapie en daarna 3 keer per week Een leverbiopsie of beenmergbiopsie kan nuttig of belangrijk zijn tijdens langdurige of hoge dosistherapie.
Longfunctietest
Longfunctietesten kunnen nuttig zijn als longziekte wordt vermoed, vooral als er baselinegegevens beschikbaar zijn.
Serumspiegels van methotrexaat
Controle van de serumspiegels van methotrexaat kan de toxiciteit en mortaliteit aanzienlijk verminderen. Patiënten met de volgende aandoeningen zijn vatbaar voor het ontwikkelen van hoge of langdurige methotrexaatspiegels en hebben baat bij periodieke controle van het niveau: pleurale effusie, ascites, occlusie van het maagdarmkanaal, eerdere behandeling met cisplatine, dehydratie, acidurie, verminderde nierfunctie.
Sommige patiënten kunnen een verlengde klaring van methotrexaat hebben zonder deze kenmerken. Het is belangrijk dat patiënten binnen 48 uur worden geïdentificeerd, aangezien de toxiciteit van methotrexaat mogelijk niet omkeerbaar is als de calciumfolinaat-rescue langer dan 42-48 uur wordt uitgesteld.
De methode voor het bewaken van de methotrexaatconcentraties varieert van centrum tot centrum.
Controle van de methotrexaatconcentraties moet de bepaling van de methotrexaatspiegels na 24, 48 of 72 uur omvatten en de beoordeling van de snelheid waarmee de methotrexaatconcentraties afnemen (of het bepalen hoe lang de redding met calciumfolinaat moet worden voortgezet).
Interacties Welke medicijnen of voedingsmiddelen kunnen het effect van methotrexaat veranderen
Vertel het uw arts of apotheker als u kort geleden andere geneesmiddelen heeft gebruikt, ook zonder voorschrift.
Salicylaten, sommige sulfonamiden, para-amino-benzoëzuur (PABA), fenylbutazon, difenylhydantoïne, tetracyclines en chlooramfenicol kunnen de binding van methotrexaat aan plasma-eiwitten verdringen Methotrexaat bindt gedeeltelijk aan serumalbumine en de toxiciteit kan toenemen door verdringing veroorzaakt door andere sterk bindende geneesmiddelen aan plasma-eiwitten, zoals salicylaten, fenylbutazon, fenytoïne en sulfonamiden en sommige antibiotica zoals penicillines, tetracycline, pristinamycine, probenecide en chlooramfenicol
Aangezien methotrexaat onveranderd wordt uitgescheiden door renale excretie na glomerulaire filtratie, actieve tubulaire secretie en passieve tubulaire reabsorptie, kan elk nefrotoxisch geneesmiddel de renale excretie van methotrexaat verminderen.Daarom is het een goede gewoonte om deze geneesmiddelen niet toe te dienen tijdens de behandeling met methotrexaat. Het transport van methotrexaat door de nieren wordt verminderd door probenecide, het gebruik van methotrexaat met dit geneesmiddel moet zorgvuldig worden gecontroleerd. Fenylbutazon in combinatie met methotrexaat heeft in sommige gevallen toxiciteit veroorzaakt met koorts en huidulcera, beenmergdepressie en overlijden bij bloedvergiftiging. Het mechanisme van deze actie is drievoudig: verdringing van methotrexaat van binding aan plasma-eiwitten, remming van renale tubulaire secretie en beenmergdepressie. Bovendien lijkt fenylbutazon ook nierbeschadiging te veroorzaken, wat kan leiden tot een ophoping van methotrexaat.
Niet-steroïde anti-inflammatoire geneesmiddelen (NSAID's) mogen niet worden gegeven vóór of in combinatie met hooggedoseerde regimes van methotrexaat, zoals die worden gebruikt bij de behandeling van osteosarcoom. Er is gemeld dat gelijktijdige toediening van NSAID's met hoge doses behandeling met methotrexaat verhoogt en verlengt de serumspiegels van methotrexaat in de loop van de tijd, wat de dood tot gevolg heeft als gevolg van ernstige hematologische en gastro-intestinale toxiciteit (zie "SPECIALE WAARSCHUWINGEN"). Van NSAID's en salicylaten is gemeld dat ze de tubulaire secretie van methotrexaat verminderen in een diermodel en deze kunnen versterken. toxiciteit door verhoging van methotrexatemie. Daarom is voorzichtigheid geboden bij gelijktijdige toediening van NSAID's of salicylaten met lagere doses methotrexaat (zie "SPECIALE WAARSCHUWINGEN").
Een toename van de nefrotoxiciteit veroorzaakt door methotrexaat in hoge doses is waargenomen bij toediening in combinatie met potentieel nefrotoxische chemotherapeutica (bijv. cisplatine). Methotrexaat in combinatie met leflunomide kan het risico op pancytopenie verhogen.
Bij de behandeling van patiënten met osteosarcoom is voorzichtigheid geboden bij het toedienen van hoge doses methotrexaat in combinatie met een mogelijk nefrotoxisch chemotherapeutisch middel (bijv. cisplatine).
Wanneer een hoge dosis methotrexaat wordt toegediend in combinatie met potentieel nefrotoxische chemotherapeutica (bijv. cisplatine), kan verhoogde nefrotoxiciteit worden waargenomen. De klaring van methotrexaat wordt verminderd door cisplatine. Orale antibiotica zoals tetracyclines, chlooramfenicol en breedspectrum-gastro-intestinale (niet-resorbeerbare) antibiotica kunnen de intestinale absorptie van methotrexaat verminderen of de enterohepatische circulatie verstoren door de darmflora te remmen en het metabolisme van het geneesmiddel door bacteriën te onderdrukken.
Penicillines en sulfonamiden kunnen de renale klaring van methotrexaat verminderen; Verhoogde serumconcentraties van methotrexaat met gelijktijdige hematologische en gastro-intestinale toxiciteit zijn waargenomen bij zowel lage als hoge doses. Daarom moet het gebruik van methotrexaat met penicillines nauwlettend worden gecontroleerd. Het potentieel voor verhoogde hepatotoxiciteit gerelateerd aan gelijktijdige toediening van methotrexaat met andere hepatotoxische middelen is niet geëvalueerd. In dergelijke gevallen is echter hepatotoxiciteit gemeld.
Daarom moeten patiënten die methotrexaat gebruiken en die andere potentieel hepatotoxische geneesmiddelen gebruiken (bijv. leflunomide, azathioprine, retinoïden, sulfasalazine) nauwlettend worden gecontroleerd op een mogelijk verhoogd risico op hepatotoxiciteit.
Er is gemeld dat trimethoprim/sulfamethoxazol in zeldzame gevallen heeft geleid tot een verhoogde beenmergsuppressie bij patiënten die met methotrexaat werden behandeld, mogelijk als gevolg van verminderde tubulaire secretie en/of een additief antipholic effect.
Gelijktijdig gebruik van het antiprotozoaire pyrimethamine kan de toxische effecten van methotrexaat versterken vanwege een cumulatief antifolisch effect.
Methotrexaat verhoogt de plasmaspiegels van mercaptopurines. De combinatie van methotrexaat en mercaptopurine kan daarom een dosisaanpassing vereisen.
Vitaminepreparaten die foliumzuur of derivaten bevatten, kunnen de respons op systemisch toegediend methotrexaat verminderen, maar folaatdeficiëntie kan de toxiciteit van methotrexaat verhogen. Hoge doses leucovorine kunnen de werkzaamheid van intrathecaal toegediend methotrexaat verminderen.
Methotrexaat, dat tegelijk met radiotherapie wordt gegeven, kan het risico op necrose van de weke delen en osteonecrose verhogen.
Methotrexaat, intrathecaal toegediend met intraveneus cytarabine, kan het risico op ernstige neurologische bijwerkingen verhogen, waaronder hoofdpijn, verlamming, coma en beroerte-achtige episodes (zie "VOORZORGSMAATREGELEN BIJ GEBRUIK").
Geconcentreerde erytrocyten (verpakte rode bloedcellen)
Voorzichtigheid is geboden wanneer geconcentreerde rode bloedcellen en methotrexaat gelijktijdig worden toegediend. Patiënten die een 24-uurs methotrexaat-infusie en daaropvolgende transfusies kregen, ondervonden een verhoogde toxiciteit, mogelijk als gevolg van verlengde en verhoogde serumconcentraties van methotrexaat.
Psoraleen en UVA-bestralingstherapie (PUVA)
Huidkanker is gemeld bij sommige patiënten met psoriasis of mycosis fungoides (cutaan T-cellymfoom) die een combinatiebehandeling kregen met methotrexaat plus PUVA-therapie (xanthotoxine en ultraviolette straling).
Protonpompremmers
Gelijktijdige toediening van protonpompremmers (PPI's) en methotrexaat kan de klaring van methotrexaat verminderen, wat resulteert in verhoogde plasmaspiegels van methotrexaat met klinische tekenen en symptomen van methotrexaattoxiciteit. Indien mogelijk moet gelijktijdig gebruik van PPI en hoge doses methotrexaat worden vermeden en moet voorzichtigheid worden betracht bij patiënten met nierinsufficiëntie.
Distikstofoxide-anesthesie
Lachgas dat als anestheticum wordt gebruikt, versterkt het effect van methotrexaat op het folaatmetabolisme, wat resulteert in ernstige en onvoorspelbare stomatitis en myelosuppressie. Dit effect kan worden verminderd door foliumzuur als noodmedicatie te gebruiken.Methotrexaat kan de theofyllineklaring verminderen; theofyllinespiegels moeten worden gecontroleerd bij gelijktijdige toediening met Methotrexaat.
diuretica
Myelosuppressie en verlaagde folaatspiegels zijn gemeld bij gelijktijdige toediening van triamtereen en methotrexaat.
Amiodaron
Toediening van amiodaron aan patiënten die methotrexaat worden behandeld voor door psoriasis veroorzaakte ulceratieve huidlaesies.
L-asparaginase
Er is gemeld dat toediening van L-asparaginase het effect van methotrexaat tegenwerkt.
Ciprofloxacine
Het transport naar de niertubuli wordt verminderd door ciprofloxacine; het gebruik van methotrexaat met dit geneesmiddel moet nauwlettend worden gecontroleerd.
Waarschuwingen Het is belangrijk om te weten dat:
Dodelijke toxiciteiten zijn gemeld als gevolg van fouten in intraveneuze en intrathecale dosisberekeningen. Er moet speciale aandacht worden besteed aan de berekening van de dosis.
Vanwege de mogelijkheid van ernstige toxische reacties (die fataal kunnen zijn), mag methotrexaat alleen worden gebruikt voor levensbedreigende neoplastische ziekten. Er zijn gevallen van overlijden gemeld bij het gebruik van methotrexaat bij de behandeling van neoplasmata.Vanwege de mogelijkheid van ernstige toxische reacties moet de patiënt door de arts worden geïnformeerd over de risico's en onder voortdurend medisch toezicht blijven.
Er zijn sterfgevallen gemeld bij het gebruik van methotrexaat bij de behandeling van maligniteiten.Het gebruik van de hoge doseringen van methotrexaat aanbevolen bij de behandeling van osteosarcoom vereist speciale aandacht.Hoge doseringsschema's voor andere maligniteiten worden als experimenteel beschouwd en zijn niet Methotrexaatformuleringen en verdunningsmiddelen die conserveermiddelen bevatten, mogen niet worden gebruikt voor intrathecale toediening of voor behandeling met hoge doses methotrexaat.
Methotrexaat veroorzaakt hepatotoxiciteit, leverfibrose en cirrose, maar over het algemeen alleen na langdurig gebruik. Acute stijgingen van leverenzymen zijn vaak waargenomen; deze zijn over het algemeen van voorbijgaande aard en asymptomatisch en lijken ook niet voorspellend voor een volgende leverziekte. Leverbiopsie na langdurig gebruik vertoont vaak histologische veranderingen en fibrose en cirrose zijn gemeld.
Methotrexaat zorgde ervoor dat de hepatitis B-infectie opnieuw werd geactiveerd of de hepatitis C-infectie verergerde, in sommige gevallen met de dood tot gevolg. Sommige gevallen van hepatitis B-reactivering zijn opgetreden na stopzetting van methotrexaat Klinische en laboratoriumevaluatie moet worden uitgevoerd om een reeds bestaande leverziekte te evalueren bij patiënten met eerdere hepatitis B- en C-infecties Op basis van deze beoordelingen is behandeling met Methotrexaat mogelijk niet geïndiceerd voor sommige patiënten.
Methotrexaat wordt na absorptie gedeeltelijk gebonden aan serumalbumine en de toxiciteit ervan kan toenemen na de verdringing veroorzaakt door bepaalde geneesmiddelen, zoals salicylaten, sulfonamiden, difenylhydantoïne en verschillende antibacteriële middelen, zoals tetracyclines, chlooramfenicol en parazuur. . Deze geneesmiddelen, met name salicylaten en sulfonamiden, of ze nu antibacterieel, hypoglykemisch of diuretisch zijn, mogen niet gelijktijdig met methotrexaat worden toegediend totdat het belang en de significantie van deze klinische gegevens zijn vastgesteld.Vitaminepreparaten die foliumzuur of zijn derivaten bevatten, kunnen de respons op methotrexaat veranderen totdat het volledige neutralisatie.
Eliminatie van methotrexaat uit de derde ruimte (bijv. pleurale effusie of ascites) gebeurt langzaam, wat resulteert in een verlenging van de terminale plasmahalfwaardetijd en onverwachte toxiciteit. Bij patiënten met een aanzienlijke vochtophoping in de derde ruimte, is het raadzaam om de effusie vóór de behandeling met methotrexaat op te zuigen en de plasmaspiegels te controleren.
Methotrexaat moet met uiterste voorzichtigheid worden gebruikt bij infecties, maagzweren, colitis ulcerosa, verzwakking en bij zeer jonge of zeer oude patiënten. Diarree en ulceratieve stomatitis vereisen stopzetting van de behandeling, anders kunnen hemorragische enteritis en overlijden na darmperforatie optreden.
Methotrexaat moet met uiterste voorzichtigheid worden gebruikt in aanwezigheid van bestaande infecties en is gewoonlijk gecontra-indiceerd bij patiënten met manifest of laboratorium-aangetoond immunodeficiëntiesyndroom.
Als tijdens de behandeling ernstige leukopenie optreedt, kan een bacteriële infectie optreden; in dit geval is het raadzaam om het gebruik van het geneesmiddel te staken en een adequate antibiotische therapie te starten. Bij ernstige onderdrukking van de beenmergactiviteit zijn bloed- of bloedplaatjestransfusies vereist.
Maligne lymfomen kunnen optreden bij patiënten die een lage dosis methotrexaat krijgen, wat kan afnemen na stopzetting van de behandeling met methotrexaat, en daarom is mogelijk geen cytotoxische behandeling nodig. Stop eerst met Methotrexaat en als het lymfoom niet achteruitgaat, start dan een geschikte behandeling.
Net als andere cytotoxische geneesmiddelen kan methotrexaat een "tumorlysissyndroom" veroorzaken bij patiënten met snelgroeiende tumoren. Passende ondersteunende en farmacologische maatregelen kunnen deze complicatie voorkomen of verlichten.
Onverwacht ernstige (soms fatale) onderdrukking van beenmergactiviteit, aplastische anemie en gastro-intestinale toxiciteit zijn gemeld bij gelijktijdige toediening van methotrexaat (meestal in hoge doses) en NSAID's.
Door methotrexaat geïnduceerde longziekte, waaronder acute of chronische interstitiële pneumonie en pleurale effusie, kan op elk moment tijdens de therapie optreden; het is gemeld bij lage doses. Het is niet altijd volledig omkeerbaar en er zijn gevallen met fatale afloop gemeld.
Bij longsymptomen (vooral droge, niet-productieve hoest) kan het nodig zijn de behandeling te staken en zorgvuldig te onderzoeken.
Methotrexaat bleek een immunosuppressieve werking uit te oefenen; met dit effect moet rekening worden gehouden bij de evaluatie van het gebruik van het geneesmiddel wanneer de immunologische respons bij een patiënt belangrijk of essentieel kan zijn.
Levensbedreigende opportunistische infecties, met name Pneumocystis carinii-pneumonie, kunnen optreden bij behandeling met methotrexaat. Wanneer een patiënt longsymptomen vertoont, moet altijd rekening worden gehouden met de mogelijkheid van Penumocystis carinii-pneumonie. Houd er rekening mee dat tijdens een behandeling met methotrexaat met hoge doses het essentieel is om een diurese van ten minste 2 liter in 24 uur en een urine-pH van niet minder dan 6,5 te verzekeren.
Methotrexaat kan ernstige hematopoëtische weefseldepressie veroorzaken en moet met voorzichtigheid worden gebruikt bij patiënten met een verminderde beenmergfunctie en eerdere of gelijktijdige breedveldradiotherapie. Alle patiënten die een behandeling met methotrexaat ondergaan, moeten zorgvuldig worden gecontroleerd en de volgende symptomen zijn tekenen van toxiciteit: gastro-intestinale ulceratie en bloeding, waaronder stomatitis, beenmergdepressie, die voornamelijk de elementen van de witte reeks aantast, en alopecia. In het algemeen is bij elk individu de toxiciteit direct gerelateerd aan de dosis.
Methotrexaat, dat tegelijk met radiotherapie wordt gegeven, kan het risico op necrose van de weke delen en osteonecrose verhogen.
Methotrexaat mag niet samen met andere geneesmiddelen in hetzelfde infuus worden toegediend.
Geneesmiddel dat natrium bevat, is daarom niet geschikt voor personen die een natriumarm dieet moeten volgen.
Zwangerschap, borstvoeding en vruchtbaarheid
Vraag uw arts of apotheker om advies voordat u een geneesmiddel inneemt.
Vruchtbaarheid
Er is gemeld dat methotrexaat verminderde vruchtbaarheid, oligospermie en menstruele disfunctie bij mensen veroorzaakt, tijdens en gedurende korte tijd na stopzetting van de behandeling.
Zwangerschap
De risico's van effecten op de voortplanting moeten worden besproken met patiënten van beide geslachten die methotrexaat krijgen.
Methotrexaat is gecontra-indiceerd tijdens de zwangerschap. Het gebruik ervan kan teratogene effecten, foetale dood, embryotoxiciteit en abortus veroorzaken bij toediening aan zwangere vrouwen. Bij de behandeling van neoplastische ziekten mag het alleen worden gebruikt als de mogelijke voordelen opwegen tegen het risico voor de foetus
Vrouwen in de vruchtbare leeftijd mogen geen behandeling met methotrexaat starten totdat zwangerschap is uitgesloten; zij moeten volledig worden geïnformeerd over de ernstige risico's voor de foetus als zwangerschap optreedt tijdens de behandeling met methotrexaat. Als een van beide partners wordt behandeld met methotrexaat, moet zwangerschap worden vermeden. Het optimale tijdsinterval tussen het einde van de behandeling met Methotrexaat door beide partners en het zwanger worden is nog niet duidelijk vastgesteld (zie "Contra-indicaties"). De aanbevelingen met betrekking tot de tijdsintervallen, ontleend aan de gepubliceerde literatuur, variëren van 3 maanden tot een jaar.
Voedertijd
Methotrexaat wordt aangetroffen in moedermelk. Methotrexaat is gecontra-indiceerd bij vrouwen die borstvoeding geven vanwege het potentieel om ernstige bijwerkingen bij de zuigeling te veroorzaken.
De hoogste verhouding van methotrexaatconcentraties in moedermelk tot plasma was 0,08:1.
Als het nodig is om het medicijn toe te dienen tijdens het geven van borstvoeding, moet het worden gestopt voordat de behandeling wordt gestart.
Beïnvloeding van de rijvaardigheid en het vermogen om machines te bedienen
Sommige effecten die worden genoemd in de rubriek "Bijwerkingen", zoals duizeligheid en vermoeidheid, kunnen de rijvaardigheid of het vermogen om machines te bedienen beïnvloeden.
Gebruik bij oudere patiënten
Vooral bij oudere patiënten zijn dodelijke toxiciteiten gemeld als gevolg van een verkeerde dagelijkse inname in plaats van wekelijkse inname. Patiënten moeten erop gewezen worden dat de aanbevolen dosis wekelijks moet worden ingenomen voor reumatoïde artritis en psoriasis (zie "Voorzorgsmaatregelen bij gebruik").
Vanwege een verminderde lever- en nierfunctie en verminderde folaatreserves bij oudere patiënten, moeten lagere doses worden overwogen en deze patiënten moeten nauwlettend worden gecontroleerd op de vroegste tekenen van toxiciteit.
Gebruik bij pediatrische patiënten
De veiligheid en werkzaamheid bij pediatrische patiënten zijn alleen vastgesteld voor chemotherapie tegen kanker en polyarticulaire juveniele idiopathische artritis.
Gepubliceerde klinische onderzoeken naar het gebruik van methotrexaat bij kinderen en adolescenten (dwz patiënten van 2 tot 16 jaar) met juveniele idiopathische artritis hebben een veiligheid aangetoond die vergelijkbaar is met die waargenomen bij volwassenen met reumatoïde artritis.
Dodelijke toxiciteiten zijn gemeld als gevolg van fouten in intraveneuze en intrathecale dosisberekeningen. Overdosering is opgetreden als gevolg van fouten in intraveneuze en intrathecale dosisberekeningen (vooral bij jongeren). Bijzondere aandacht moet worden besteed aan het berekenen van de dosis (zie "Voorzorgsmaatregelen bij gebruik").
Geneesmiddel dat natrium bevat, is daarom niet geschikt voor personen die een natriumarm dieet moeten volgen.
Het conserveermiddel benzylalcohol is in verband gebracht met ernstige bijwerkingen, waaronder "hijgend syndroom" en overlijden bij pediatrische patiënten. Symptomen zijn onder meer heftig begin van agonale ademhaling, hypotensie, bradycardie en cardiovasculaire collaps. Hoewel de normale therapeutische doses van dit product over het algemeen aanzienlijk lagere hoeveelheden benzylalcohol afgeven dan die gerapporteerd in verband met het "hijgsyndroom", is de minimale hoeveelheid benzylalcohol waarbij toxiciteit kan optreden niet bekend. Het risico op benzylalcoholtoxiciteit hangt af van de toegediende hoeveelheid en het vermogen van de lever om chemicaliën te elimineren. Premature en laag gewicht zuigelingen kunnen meer vatbaar zijn voor het ontwikkelen van toxiciteit.
Ernstige neurotoxiciteit, die zich vaak manifesteert in de vorm van gegeneraliseerde of focale aanvallen, is gemeld bij pediatrische patiënten met acute lymfatische leukemie die werden behandeld met intraveneus methotrexaat (1 g/m2).
Dosering en wijze van gebruik Hoe gebruikt u Methotrexaat: Dosering
De gebruikte doseringsschema's verschillen aanzienlijk van onderzoeker tot onderzoeker en afhankelijk van de aard en ernst van de ziekte.De meest recente literatuur en de ervaring van de arts vertegenwoordigen enkele van de factoren die de keuze van de dosering en de duur van de therapie kunnen beïnvloeden.
Sinds enkele jaren en voor sommige neoplastische vormen wordt met goede resultaten een hoge dosis Methotrexaat gecombineerd met calciumfolinaat "redding" gebruikt. Er moet echter rekening mee worden gehouden dat het gebruik van regimes met hoge doses bij de behandeling van andere neoplastische ziekten dan osteosarcoom in een experimentele fase moet worden overwogen en dat een therapeutisch voordeel van deze benadering niet is vastgesteld. Hoge doses mogen alleen worden gebruikt door gekwalificeerde artsen en in een ziekenhuisomgeving (bij voorkeur op kankerafdelingen).
"Redding" met calciumfolinaat in een hoge dosis Methotrexaat-therapie.
Volgens de meest recente aanwinsten, om de therapeutische index van methotrexaat te verbeteren, wordt calciumfolinaat gebruikt in een sequentiële antidotische behandeling ("redding" met calciumfolinaat). "redding" met calciumfolinaat, is het in feite mogelijk om tumorvormen beter onder controle te houden zonder tegelijkertijd een significante toename van de toxiciteit vast te leggen. "Redding" voorziet in het gebruik van calciumfolinaat via parenterale weg in de eerste fase die overeenkomt met antidotisme voor competitie; mondeling in de tweede fase waarin vooral de biochemisch-metabolische component een rol speelt. De "reddings"-doses en -schema's variëren afhankelijk van de gekozen aanpak.Hieronder vindt u enkele richtlijnen met betrekking tot het verdraagbaarheidsprofiel van therapie met hoge doses methotrexaat geassocieerd met "redding" met calciumfolinaat en een tabel met algemene richtlijnen voor de dosering van calciumfolinaat op basis van de serumspiegels van methotrexaat. Het is ook raadzaam om de meest recente literatuur te raadplegen.
RICHTLIJNEN VOOR HOGE DOSERING VAN METHOTREXAAT IN VERBAND MET REDDING MET CALCIUMFOLINAAT
1. De toediening van methotrexaat moet worden uitgesteld (totdat de normale waarden van de hieronder aangegeven parameters zijn hersteld) als:
- het aantal witte bloedcellen is minder dan 1500 / microliter
- het aantal neutrofielen is minder dan 200 / microliter
- het aantal bloedplaatjes is minder dan 75.000 / microliter
- het serumbilirubinegehalte is hoger dan 1,2 mg/dl
- het niveau van SGPT is boven 450U
- mucositis aanwezig is (en totdat het genezingsproces duidelijk is)
- er is een aanhoudende pleurale effusie; deze effusie moet vóór de infusie worden opgezogen
2. Adequate nierfunctie moet worden gedocumenteerd:
- Serumcreatinine moet normaal zijn en de creatinineklaring moet groter zijn dan 60 ml/min. voordat u met de therapie begint.
- Serumcreatinine moet vóór elke volgende therapiekuur worden gemeten. Als het serumcreatinine met 50% of meer is gestegen ten opzichte van de vorige waarde, moet de creatinineklaring worden geëvalueerd en vastgesteld dat deze nog steeds boven de 60 ml/min ligt (zelfs als het serumcreatinine nog steeds binnen het normale bereik ligt).
3. Patiënten moeten goed gehydrateerd zijn en behandeld worden met natriumbicarbonaat om de urine te alkaliseren.
- Dien 1000 ml/m2 vloeistof intraveneus toe binnen 6 uur voor aanvang van de infusie van Methotrexaat. Blijf de patiënt hydrateren met 125 ml/m2/u (3 liter/m2/dag) tijdens de methotrexaat-infusie en gedurende twee dagen na de infusie.
- Alkaliseer urine om de pH boven 7,0 te houden tijdens methotrexaatinfusie en calciumfolinaattherapie. Dit kan worden bereikt door orale toediening van natriumbicarbonaat of door intraveneuze toediening in een aparte oplossing.
4. Meet de serumcreatinine- en serumconcentratie van methotrexaat 24 uur na het begin van de methotrexaatinfusie en ten minste eenmaal per dag totdat de methotrexaatspiegel onder 0,05 micromol is gedaald.
5. De volgende tabel geeft algemene richtlijnen voor de dosering van calciumfolinaat op basis van de serumspiegels van methotrexaat (zie onderstaande tabel).
Patiënten met een vertraging in de vroege eliminatiefase van methotrexaat hebben meer kans op het ontwikkelen van onomkeerbaar oligurisch nierfalen. Naast een geschikte behandeling met calciumfolinaat, hebben deze patiënten voortdurende hydratatie en alkalisering van de urine nodig, en nauwlettende controle van de vocht- en elektrolytenstatus, totdat de serummethotrexaatspiegels zijn gedaald tot onder 0,05 micromol en het nierfalen niet is verdwenen. Indien nodig, intermitterende hemodialyse met een high-flow dialysator kan nuttig zijn bij deze patiënten.
6. Sommige patiënten zullen afwijkingen hebben in de eliminatie van methotrexaat, of afwijkingen in de nierfunctie na toediening van methotrexaat, die significant zijn, maar minder ernstig dan de afwijkingen beschreven in onderstaande tabel.Deze afwijkingen kunnen al dan niet geassocieerd zijn met significante klinische toxiciteit Als er significante klinische toxiciteit optreedt, moet de calciumfolinaat-rescue nog 24 uur worden voortgezet (voor een totaal van 14 doses gedurende 84 uur) in volgende therapiekuren De mogelijkheid dat de patiënt andere geneesmiddelen gebruikt die een wisselwerking hebben met methotrexaat (bijv. geneesmiddelen die de binding van methotrexaat aan serumalbumine of de eliminatie ervan kunnen verstoren) moeten altijd worden overwogen wanneer abnormale laboratoriumtests of klinische toxiciteit worden waargenomen.
WAARSCHUWING: GEEF GEEN CALCIUMFOLINAAT INTRATHECAAL.
RICHTLIJNEN VOOR DE DOSERING VAN CALCIUMFOLINAAT ALS REDDINGSTHERAPIE NA HET "GEBRUIK VAN HOGERE DOSIS" VAN METHOTREXAAT
Gebruiksaanwijzing:
Mensen die in aanraking komen met kankermedicijnen of werken in gebieden waar deze medicijnen worden gebruikt, kunnen aan deze middelen worden blootgesteld, hetzij door contact met de lucht, hetzij door direct contact met besmette voorwerpen. Potentiële gezondheidseffecten kunnen worden verminderd door zich te houden aan institutionele procedures, gepubliceerde richtlijnen en lokale regelgeving met betrekking tot de bereiding, toediening, transport en verwijdering van gevaarlijke medicijnen. Er is geen algemene overeenstemming dat alle procedures die in de richtlijnen worden aanbevolen, noodzakelijk en passend zijn.
Methotrexaat poeder voor oplossing voor injectie:
Methotrexaat 500 mg en Methotrexaat 1 g poeder voor oplossing voor injectie moeten onmiddellijk voor gebruik worden gereconstitueerd met respectievelijk 10 ml en 20 ml water voor injecties of fysiologische zoutoplossing of 5% dextrose-oplossing, die geen conserveermiddelen bevat. / ml, reconstitueer de fles met 1 g methotrexaat met 19,4 ml vloeistof.
Methotrexaat 50 mg poeder voor oplossing voor injectie moet onmiddellijk voor gebruik worden gereconstitueerd met water voor injectie met 20 ml water.
Wanneer hoge doses methotrexaat worden toegediend via intraveneuze infusie, verdun dan de totale dosis in 5% dextrose-oplossing.
Voor intrathecale toediening, reconstitueer tot een concentratie van 1 mg/ml met behulp van een geschikte steriele oplossing, vrij van bewaarmiddelen, zoals zoutoplossing.
Methotrexaatoplossing
Indien nodig kan de oplossing, direct voor gebruik, verder worden verdund met fysiologische zoutoplossing of 5% dextrose-oplossing, die geen conserveermiddelen bevat.
De flessen zijn voor eenmalig gebruik.
Als zich een neerslag vormt, moet de oplossing worden weggegooid.
Dien Methotrexaat niet toe met andere geneesmiddelen in hetzelfde infuus.
Overdosering Wat moet u doen als u te veel Methotrexaat heeft ingenomen?
In postmarketingervaring zijn gevallen van overdosering met methotrexaat over het algemeen voorgekomen bij orale en intrathecale toediening, hoewel gevallen van overdosering bij intraveneuze en intramusculaire toediening zijn gemeld.
Er zijn gevallen van overdosering in de literatuur waarin intraveneuze en intrathecale behandeling van carboxypeptidase G2 werd gebruikt om de klaring van methotrexaat te versnellen.
Stop of verlaag de dosis bij het eerste teken van ulceratie of bloeding, diarree of duidelijke depressie van het hematopoëtische systeem.
Symptomen van een intrathecale overdosis methotrexaat zijn meestal neurologisch, waaronder hoofdpijn, misselijkheid en braken, convulsies of toevallen en acute toxische encefalopathie. In sommige gevallen werden geen symptomen gemeld.
Er zijn meldingen geweest van sterfgevallen als gevolg van intrathecaal toegediende overdoses. Cerebellaire hernia geassocieerd met verhoogde intracraniale druk en acute toxische encefalopathie zijn in deze gevallen ook gemeld.
Calciumfolinaat is geïndiceerd om de toxiciteit te verminderen en de effecten tegen te gaan van een overdosis methotrexaat die per ongeluk wordt toegediend. De toediening van calciumfolinaat moet zo snel mogelijk worden gestart. Naarmate het interval tussen de toediening van methotrexaat en het begin van de behandeling met calciumfolinaat toeneemt, neemt de activiteit ervan bij het tegengaan van toxiciteit af.
Calciumfolinaat, een specifiek tegengif van methotrexaat, maakt het mogelijk om de toxische effecten van de antimetaboliet op het hematopoëtische systeem en op de slijmvliezen van het spijsverteringsstelsel te neutraliseren. In zijn rol als tegengif wordt calciumfolinaat in verschillende doseringen gebruikt, afhankelijk van het te bereiken effect.In geval van accidentele overdosering wordt calciumfolinaat voor intraveneuze infusie (tot 100 mg binnen 12 uur) aanbevolen om een competitief effect te verkrijgen. ; om een metabool biochemisch effect te verkrijgen wordt calciumfolinaat intramusculair aanbevolen (10-12 mg elke 6 uur voor 4 doses) of oraal (15 mg elke 6 uur voor 4 doses).
In geval van accidentele toediening moet calciumfolinaat binnen het eerste uur worden toegediend in doses gelijk aan of hoger dan die van methotrexaat; de toediening van calciumfolinaat in latere tijden is minder effectief. Controle van de serumconcentratie van Methotrexaat is essentieel om de optimale dosis en duur van de behandeling met calciumfolinaat te bepalen.
In het geval van een grote overdosis kan hydratatie en alkalisatie van de urine nodig zijn om precipitatie van methotrexaat en/of zijn metabolieten in de niertubuli te voorkomen. Noch hemodialyse, noch peritoneale dialyse bleken de eliminatie van methotrexaat te verbeteren. Er is echter een effectieve klaring van methotrexaat gemeld bij het gebruik van intermitterende hemodialyse met een high-flux dialysator.
Accidentele intrathecale overdosering kan intensieve systemische ondersteuning, hoge doses calciumfolinaat, alkalische diurese en snelle CSF-drainage en ventriculolumbale perfusie vereisen.
In geval van accidentele inname/inname van een overmatige dosis methotrexaat, waarschuw dan onmiddellijk uw arts of ga naar het dichtstbijzijnde ziekenhuis.
Als u nog vragen heeft over het gebruik van methotrexaat, neem dan contact op met uw arts of apotheker.
Bijwerkingen Wat zijn de bijwerkingen van Methotrexaat
Zoals alle geneesmiddelen kan Methotrexaat bijwerkingen veroorzaken, al krijgt niet iedereen daarmee te maken.
Zie de relevante rubrieken voor informatie over bijwerkingen die verband houden met methotrexaat.
De meest voorkomende bijwerkingen zijn: ulceratieve stomatitis, leukopenie, misselijkheid en buikpijn. Andere vaak gemelde bijwerkingen zijn: malaise en overmatige vermoeidheid, koude rillingen en koorts, duizeligheid, verminderde weerstand tegen infecties.
De allereerste tekenen van toxiciteit worden meestal weergegeven door ulceraties van het mondslijmvlies.
De ernst en incidentie van acute bijwerkingen zijn over het algemeen gerelateerd aan de dosering en frequentie van toediening.
Andere mogelijke bijwerkingen die zijn gemeld met methotrexaat per systeemorgaan en per frequentie worden hieronder vermeld. In de oncologische setting maken gelijktijdige behandelingen en reeds bestaande ziekten het moeilijk om een specifieke reactie aan methotrexaat toe te schrijven Zie rubriek 4.4 voor specifieke verwijzingen naar langdurige en medisch belangrijke gebeurtenissen, inclusief die na behandeling langdurig of bij hoge cumulatieve doses (bijv. levertoxiciteit).
Frequentiecategorieën zijn gedefinieerd als: zeer vaak (≥ 1/10), vaak (≥ 1/100,
* alleen voor injecteren
Naleving van de instructies in de bijsluiter verkleint de kans op bijwerkingen.
Melding van bijwerkingen
Krijgt u last van bijwerkingen, neem dan contact op met uw arts of apotheker.Dit geldt ook voor mogelijke bijwerkingen die niet in deze bijsluiter staan. Bijwerkingen kunnen ook rechtstreeks worden gemeld via het nationale meldsysteem op "https://www.aifa.gov.it/content/segnalazioni-reazioni-avverse". Door bijwerkingen te melden, kunt u ons helpen meer informatie te verkrijgen over de veiligheid van dit geneesmiddel
Vervaldatum en retentie
Methotrexaat poeder voor oplossing voor injectie: bewaren bij een temperatuur van maximaal 25 ° C. Beschermen tegen licht en vocht.
Methotrexaatoplossing voor injectie: bewaren bij een temperatuur tussen 15°C-22°C. Bescherm tegen licht.
Vervaldatum: Zie de vervaldatum op de verpakking.
Waarschuwing: gebruik het geneesmiddel niet meer na de vervaldatum die staat vermeld op de verpakking.
De aangegeven houdbaarheidsdatum verwijst naar het product in intacte verpakking, correct bewaard. De vervaldatum verwijst naar de laatste dag van de maand.
Geneesmiddelen dienen niet weggegooid te worden via het afvalwater of met huishoudelijk afval. Vraag uw apotheker wat u met geneesmiddelen moet doen die u niet meer gebruikt. Dit helpt het milieu te beschermen.
HOUD HET GENEESMIDDEL BUITEN HET ZICHT EN BEREIK VAN KINDEREN.
GEBRUIK METHOTREXAAT GEEN HANDSTUK ALS U ZWANGER BENT OF VAN PLAN BENT ZWANGER TE WORDEN.
SAMENSTELLING
Methotrexaat 50 mg poeder voor oplossing voor injectie:
Eén fles gevriesdroogd poeder bevat:
Actief bestanddeel: Methotrexaatnatriumzout 54,84 mg overeenkomend met methotrexaat 50 mg.
Hulpstoffen: natriumchloride, natriumhydroxide. Bevat geen bewaarmiddelen.
Methotrexaat 500 mg poeder voor oplossing voor injectie:
Eén fles gevriesdroogd poeder bevat:
Actief bestanddeel: Methotrexaat natriumzout 548,4 mg overeenkomend met methotrexaat 500 mg.
Hulpstoffen: natriumhydroxide. Bevat geen bewaarmiddelen.
Methotrexaat 1 g poeder voor oplossing voor injectie:
Eén fles gevriesdroogd poeder bevat:
Actief bestanddeel: Methotrexaat natriumzout 1,097 g komt overeen met methotrexaat 1 g.
Hulpstoffen: natriumhydroxide. Bevat geen bewaarmiddelen.
Methotrexaat 50 mg / 2 ml oplossing voor injectie:
Een flesje van 50 mg in 2 ml bevat:
Actief bestanddeel: Methotrexaatnatriumzout 54,84 mg overeenkomend met methotrexaat 50 mg.
Hulpstoffen: natriumhydroxide, natriumchloride, water voor injecties. Bevat geen bewaarmiddelen.
Methotrexaat 500 mg/20 ml oplossing voor injectie:
Een flesje van 500 mg in 20 ml bevat:
Actief bestanddeel: Methotrexaat natriumzout 548,4 mg overeenkomend met methotrexaat 500 mg.
Hulpstoffen: natriumhydroxide, natriumchloride, water voor injecties. Bevat geen bewaarmiddelen.
Methotrexaat 1 g/10 ml oplossing voor injectie:
Een flesje van 1 g in 10 ml bevat:
Actief bestanddeel: Methotrexaat natriumzout 1,097 g komt overeen met methotrexaat 1 g.
Hulpstoffen: natriumhydroxide, water voor injecties. Bevat geen bewaarmiddelen.
Methotrexaat 5 g / 50 ml oplossing voor injectie:
Een flesje van 5 g in 50 ml bevat:
Actief bestanddeel: Methotrexaat natriumzout 5,484 g equivalent aan methotrexaat 5 g.
Hulpstoffen: natriumhydroxide, water voor injecties. Bevat geen bewaarmiddelen.
FARMACEUTISCHE VORM EN INHOUD
Methotrexaat 50 mg poeder voor oplossing voor injectie:
1 fles van 50 mg gevriesdroogd poeder
Methotrexaat 500 mg poeder voor oplossing voor injectie:
1 fles van 500 mg gevriesdroogd poeder
Methotrexaat 1 g poeder voor oplossing voor injectie:
1 fles van 1 g gevriesdroogd poeder
Methotrexaat 50 mg / 2 ml oplossing voor injectie:
1 fles van 50 mg in 2 ml
Methotrexaat 500 mg/20 ml oplossing voor injectie:
1 fles van 500 mg in 20 ml
Methotrexaat 1 g/10 ml oplossing voor injectie:
1 fles van 1 g in 10 ml
Methotrexaat 5 g / 50 ml oplossing voor injectie:
1 Fles van 5 g in 50 ml.
Bron Bijsluiter: AIFA (Italiaans Geneesmiddelenbureau). Inhoud gepubliceerd in januari 2016. De aanwezige informatie is mogelijk niet up-to-date.
Om toegang te hebben tot de meest actuele versie, is het raadzaam om de website van AIFA (Italian Medicines Agency) te bezoeken. Disclaimer en nuttige informatie.
01.0 NAAM VAN HET GENEESMIDDEL
HOGE DOSERING METHOTREXAAT
02.0 KWALITATIEVE EN KWANTITATIEVE SAMENSTELLING
Methotrexaat 50 mg poeder voor oplossing voor injectie:
Eén fles gevriesdroogd poeder bevat:
Actief bestanddeel: Methotrexaatnatriumzout 54,84 mg overeenkomend met methotrexaat 50 mg.
Methotrexaat 500 mg poeder voor oplossing voor injectie:
Eén fles gevriesdroogd poeder bevat:
Actief bestanddeel: Methotrexaat natriumzout 548,4 mg overeenkomend met methotrexaat 500 mg.
Methotrexaat 1 g poeder voor oplossing voor injectie:
Eén fles gevriesdroogd poeder bevat:
Actief bestanddeel: Methotrexaat natriumzout 1,097 g komt overeen met methotrexaat 1 g.
Methotrexaat 50 mg / 2 ml oplossing voor injectie:
Een flesje van 50 mg in 2 ml bevat:
Actief bestanddeel: Methotrexaatnatriumzout 54,84 mg overeenkomend met methotrexaat 50 mg.
Methotrexaat 500 mg/20 ml oplossing voor injectie:
Een flesje van 500 mg in 20 ml bevat:
Actief bestanddeel: Methotrexaat natriumzout mg 548,4 (overeenkomend met methotrexaat 500 mg).
Methotrexaat 1 g/10 ml oplossing voor injectie:
Een flesje van 1 g in 10 ml bevat:
Actief bestanddeel: Methotrexaat natriumzout 1,097 g komt overeen met methotrexaat 1 g.
Methotrexaat 5 g / 50 ml oplossing voor injectie:
Een flesje van 5 g in 50 ml bevat:
Actief bestanddeel: Methotrexaat natriumzout 5,484 g equivalent aan methotrexaat 5,0 g.
Voor de volledige lijst van hulpstoffen, zie rubriek 6.1
03.0 FARMACEUTISCHE VORM
- Poeder voor oplossing voor injectie
- Injecteerbare oplossing.
04.0 KLINISCHE INFORMATIE
04.1 Therapeutische indicaties
Methotrexaat is geïndiceerd voor de antineoplastische chemotherapiebehandeling van de volgende vormen: borstcarcinoom, choriocarcinoom en soortgelijke trofoblastische ziekten, acute en subacute lymfatische en meningeale leukemie, lymfosarcoom, mycosis fungoides.
Klinisch onderzoek heeft aangetoond dat het aanzienlijk effectiever is bij leukemie bij kinderen dan bij leukemie bij volwassenen.In sommige gevallen van acute leukemie heeft het klinische verbetering en verlengde overlevingstijd veroorzaakt voor een periode variërend van enkele weken tot 2 jaar. Het hematologische beeld, verkregen uit de bloedtest en uit de uitstrijkjes van het beenmerg na toediening van methotrexaat, kan gedurende variabele perioden bijna niet te onderscheiden zijn van de normale. De beste effecten werden waargenomen bij acute leukemieën die worden gekenmerkt door de aanwezigheid van zeer onrijpe vormen in het beenmerg en het bloed. Er zijn gunstige resultaten gemeld die zijn verkregen met methotrexaat bij choriocarcinoom.
Methotrexaat is met name geïndiceerd bij mono- of polychemotherapie voor de behandeling van: osteogeen sarcoom, acute leukemie, bronchogeen carcinoom, epidermoïde carcinoom van het hoofd en de nek.
04.2 Dosering en wijze van toediening
De gebruikte doseringsschema's verschillen aanzienlijk van onderzoeker tot onderzoeker en afhankelijk van de aard en ernst van de ziekte.De meest recente literatuur en de ervaring van de arts vertegenwoordigen enkele van de factoren die de keuze van de dosering en de duur van de therapie kunnen beïnvloeden.
Sinds enkele jaren en voor sommige neoplastische vormen wordt met goede resultaten een hoge dosis Methotrexaat gecombineerd met calciumfolinaat "redding" gebruikt. Er moet echter rekening mee worden gehouden dat het gebruik van regimes met hoge doses bij de behandeling van andere neoplastische ziekten dan osteosarcoom in een experimentele fase moet worden overwogen en dat een therapeutisch voordeel van deze benadering niet is vastgesteld. Hoge doses mogen alleen worden gebruikt door gekwalificeerde artsen en in een ziekenhuisomgeving (bij voorkeur op kankerafdelingen).
'Redding "met calciumfolinaat in hoge dosis Methotrexaat-therapie".
Volgens de meest recente aanwinsten, om de therapeutische index van methotrexaat te verbeteren, wordt calciumfolinaat gebruikt in een sequentiële antidotische behandeling ("redding" met calciumfolinaat). "redding" met calciumfolinaat, is het in feite mogelijk om tumorvormen beter onder controle te houden zonder tegelijkertijd een significante toename van de toxiciteit vast te leggen. De "redding" omvat het gebruik van calciumfolinaat via parenterale weg in de eerste fase die overeenkomt met antidotisme voor competitie; mondeling in de tweede fase waarin vooral de biochemisch-metabolische component een rol speelt. "Reddingsdoses en -schema's variëren afhankelijk van de gekozen benadering. Hieronder staan enkele richtlijnen met betrekking tot het verdraagbaarheidsprofiel van therapie met hoge doses methotrexaat geassocieerd met "redding" met calciumfolinaat en een tabel met regels algemene richtlijnen voor dosering van calciumfolinaat op basis van methotrexaat serumspiegels Het is ook raadzaam om de meest recente literatuur te raadplegen.
RICHTLIJNEN VOOR HOGE DOSERING VAN METHOTREXAAT IN VERBAND MET REDDING MET CALCIUMFOLINAAT
De toediening van Methotrexaat moet worden uitgesteld (totdat de normale waarden van de hieronder aangegeven parameters zijn hersteld) als:
• het aantal witte bloedcellen is minder dan 1500 / microliter
• het aantal neutrofielen is minder dan 200 / microliter
• het aantal bloedplaatjes is minder dan 75.000 / microliter
• de serumbilirubinespiegel is hoger dan 1,2 mg/dl
• het SGPT-niveau is hoger dan 450 U
• mucositis aanwezig is (en totdat het genezingsproces duidelijk is)
• er is een aanhoudende pleurale effusie; deze effusie moet vóór de infusie worden opgezogen
Adequate nierfunctie moet worden gedocumenteerd:
Serumcreatinine moet normaal zijn en de creatinineklaring moet groter zijn dan 60 ml/min. voordat u met de therapie begint.
Serumcreatinine moet vóór elke volgende therapiekuur worden gemeten. Als het serumcreatinine met 50% of meer is gestegen ten opzichte van de vorige waarde, moet de creatinineklaring worden geëvalueerd en vastgesteld dat deze nog steeds boven de 60 ml/min ligt (zelfs als het serumcreatinine nog steeds binnen het normale bereik ligt).
Patiënten moeten goed gehydrateerd zijn en behandeld worden met natriumbicarbonaat om de urine te alkaliseren.
Dien 1000 ml/m2 vloeistof intraveneus toe binnen 6 uur voor aanvang van de infusie van Methotrexaat. Blijf de patiënt hydrateren met 125 ml/m2/u (3 liter/m2/dag) tijdens de methotrexaat-infusie en gedurende twee dagen na de infusie.
Alkaliseer urine om de pH boven 7,0 te houden tijdens methotrexaatinfusie en calciumfolinaattherapie. Dit kan worden bereikt door orale toediening van natriumbicarbonaat of door intraveneuze toediening in een aparte oplossing.
Meet het serumcreatinine en de serumconcentratie van Methotrexaat 24 uur na het begin van de Methotrexaat-infusie en ten minste eenmaal per dag totdat de Methotrexaatspiegel onder 0,05 micromol is gedaald.
De volgende tabel geeft algemene richtlijnen voor de dosering van calciumfolinaat op basis van de serumspiegels van methotrexaat (zie onderstaande tabel).
Patiënten met een vertraging in de vroege eliminatiefase van methotrexaat hebben meer kans op het ontwikkelen van onomkeerbaar oligurisch nierfalen. Naast een geschikte behandeling met calciumfolinaat, hebben deze patiënten voortdurende hydratatie en alkalisering van de urine nodig, en nauwlettende controle van de vocht- en elektrolytenstatus, totdat de serummethotrexaatspiegels zijn gedaald tot onder 0,05 micromol en het nierfalen niet is verdwenen. Indien nodig, intermitterende hemodialyse met een high-flow dialysator kan nuttig zijn bij deze patiënten.
Sommige patiënten zullen afwijkingen hebben in de eliminatie van methotrexaat, of afwijkingen in de nierfunctie na toediening van methotrexaat, die significant zijn, maar minder ernstig dan de afwijkingen beschreven in de onderstaande tabel. Deze afwijkingen kunnen al dan niet geassocieerd zijn met significante klinische toxiciteit. significante klinische toxiciteit, moet de calciumfolinaat-rescue nog 24 uur worden voortgezet (voor een totaal van 14 doses gedurende 84 uur) in volgende therapiekuren.De mogelijkheid dat de patiënt andere geneesmiddelen gebruikt die een wisselwerking hebben met methotrexaat (p.es.geneesmiddelen die de binding van methotrexaat aan serumalbumine of de eliminatie ervan kunnen verstoren) moeten altijd worden overwogen wanneer abnormale laboratoriumtests of klinische toxiciteit worden waargenomen.
WAARSCHUWING: GEEF GEEN CALCIUMFOLINAAT INTRATHECAAL.
RICHTLIJNEN VOOR DE DOSERING VAN CALCIUMFOLINAAT ALS REDDINGSTHERAPIE NA HET "GEBRUIK VAN HOGERE DOSIS" VAN METHOTREXAAT
04.3 Contra-indicaties
Overgevoeligheid voor de werkzame stof of voor één van de hulpstoffen.
Methotrexaat is gecontra-indiceerd tijdens de zwangerschap. Het gebruik ervan kan teratogene effecten, foetale dood, embryotoxiciteit en abortus veroorzaken bij toediening aan zwangere vrouwen. Bij de behandeling van neoplastische ziekten mag het alleen worden gebruikt als de mogelijke voordelen opwegen tegen het risico voor de foetus.
Vrouwen in de vruchtbare leeftijd mogen geen behandeling met methotrexaat starten totdat zwangerschap is uitgesloten; zij moeten volledig worden geïnformeerd over de ernstige risico's voor de foetus als zwangerschap optreedt tijdens de behandeling met methotrexaat. Als een van beide partners wordt behandeld met methotrexaat, moet zwangerschap worden vermeden. Het optimale tijdsinterval tussen het beëindigen van de behandeling met Methotrexaat door beide partners en het zwanger worden is nog niet duidelijk vastgesteld (zie 4.4). De aanbevelingen met betrekking tot de tijdsintervallen, ontleend aan de gepubliceerde literatuur, variëren van 3 maanden tot een jaar.
Methotrexaat wordt aangetroffen in moedermelk. Methotrexaat is gecontra-indiceerd bij vrouwen die borstvoeding geven vanwege het potentieel om ernstige bijwerkingen bij de zuigeling te veroorzaken.
De hoogste verhouding van methotrexaatconcentraties in moedermelk tot plasma was 0,08:1.
Methotrexaatformuleringen en verdunningsmiddelen die conserveermiddelen bevatten, mogen niet worden gebruikt voor intrathecale toediening of voor behandeling met hoge doses methotrexaat.
04.4 Bijzondere waarschuwingen en passende voorzorgen bij gebruik
Algemeen
Methotrexaat kan ernstige toxische reacties veroorzaken, meestal gerelateerd aan de dosering.
Dodelijke toxiciteiten zijn gemeld als gevolg van fouten in intraveneuze en intrathecale dosisberekeningen. Er moet speciale aandacht worden besteed aan de berekening van de dosis.
Vanwege de mogelijkheid van ernstige toxische reacties (die fataal kunnen zijn) mag Methotrexaat alleen worden gebruikt in gevallen van kanker met risico op overlijden.
Er zijn sterfgevallen gemeld bij het gebruik van methotrexaat bij de behandeling van maligne neoplasmata.Vanwege de mogelijkheid van ernstige toxische reacties moet de patiënt door de arts worden geïnformeerd over de risico's en onder voortdurend medisch toezicht blijven.
Methotrexaat is gecontra-indiceerd tijdens de zwangerschap. Het gebruik ervan kan teratogene effecten, foetale dood, embryotoxiciteit en abortus veroorzaken bij toediening aan zwangere vrouwen. Bij de behandeling van neoplastische aandoeningen mag het alleen worden gebruikt als de mogelijke voordelen opwegen tegen het risico voor de foetus.Vrouwen in de vruchtbare leeftijd mogen de behandeling met methotrexaat pas starten als zwangerschap is uitgesloten; zij moeten volledig worden geïnformeerd over de ernstige risico's voor de foetus als zwangerschap optreedt tijdens de behandeling met methotrexaat. Als een van beide partners wordt behandeld met methotrexaat, moet zwangerschap worden vermeden. Het optimale tijdsinterval tussen het einde van de behandeling met Methotrexaat door beide partners en het zwanger worden is nog niet duidelijk vastgesteld (zie 4.3). De aanbevelingen met betrekking tot de tijdsintervallen, ontleend aan de gepubliceerde literatuur, variëren van 3 maanden tot een jaar. Het gebruik van de hoge doseringen van Methotrexaat aanbevolen bij de behandeling van osteosarcoom vereist speciale aandacht. Methotrexaat kan nierbeschadiging veroorzaken, wat kan leiden tot acuut nierfalen. Het wordt aanbevolen om extreme aandacht te besteden aan de nierfunctie, inclusief adequate hydratatie, alkalisering van urine, dosering van methotrexatemie en evaluatie van de nierfunctie.
Regimes met hoge doses voor andere maligniteiten worden als experimenteel beschouwd en een therapeutisch voordeel is niet vastgesteld. Formuleringen van methotrexaat en verdunningsmiddelen die conserveermiddelen bevatten, mogen niet worden gebruikt voor intrathecale toediening of voor behandeling met hoge doses methotrexaat.
De arts moet goed geïnformeerd zijn over de verschillende kenmerken van het geneesmiddel en het klinische gebruik ervan.
Patiënten die een behandeling met methotrexaat ondergaan, moeten nauwlettend worden gecontroleerd om de tekenen en symptomen van mogelijke toxische effecten of bijwerkingen zo snel mogelijk te identificeren en te evalueren. Controle vóór de behandeling en periodieke hematologische controles zijn noodzakelijk voor het gebruik van methotrexaat bij chemotherapie, vanwege het mogelijke onderdrukkende effect op de hematopoëtische functie dat aan het geneesmiddel kan worden toegeschreven.Het kan op elk moment en zelfs bij lage doses plotseling optreden.
Elke scherpe daling van het aantal bloedcellen geeft aan dat de toediening van het geneesmiddel onmiddellijk moet worden gestaakt en dat een geschikte therapie moet worden ingesteld.Bij patiënten met kanker en reeds bestaande beenmergaplasie, leukopenie, trombocytopenie of anemie, moet het product met voorzichtigheid worden gebruikt en alleen als het strikt noodzakelijk is Methotrexaat wordt voornamelijk via de nieren uitgescheiden Behandeling met methotrexaat bij patiënten met nierinsufficiëntie moet met uiterste voorzichtigheid worden uitgevoerd en met verlaagde doseringsschema's, aangezien een verminderde nierfunctie de eliminatie van methotrexaat vermindert. Het gebruik ervan, in aanwezigheid van een gestoorde nierfunctie, kan een gevaarlijke verhoging van de serumspiegels van het geneesmiddel veroorzaken en bijgevolg een verdere verergering van reeds bestaande nierschade. De nierstatus van de patiënt moet vóór en tijdens de behandeling met methotrexaat worden bepaald, waarbij grote voorzichtigheid moet worden betracht als ernstige nierinsufficiëntie wordt gevonden. In dit geval moet de dosering worden verlaagd of het geneesmiddel worden geschorst totdat de nierfunctie verbetert.
Methotrexaat veroorzaakt hepatotoxiciteit, leverfibrose en cirrose, maar over het algemeen na langdurig gebruik.
Acute stijgingen van leverenzymen zijn vaak waargenomen; deze zijn over het algemeen van voorbijgaande aard en asymptomatisch en lijken ook niet voorspellend voor een volgende leverziekte. Leverbiopsie na langdurig gebruik vertoont vaak histologische veranderingen en fibrose en cirrose zijn gemeld.
Bloedingstijd, stollingstijd en bloedgroepbepaling dienen te gebeuren vóór een transfusie of operatie.
Methotrexaat wordt na absorptie gedeeltelijk gebonden aan serumalbumine en de toxiciteit ervan kan toenemen na de verdringing veroorzaakt door bepaalde geneesmiddelen, zoals salicylaten, sulfonamiden, difenylhydantoïne en verschillende antibacteriële middelen, zoals tetracyclines, chlooramfenicol en parazuur. . Deze geneesmiddelen, met name salicylaten en sulfonamiden, of ze nu antibacterieel, hypoglycemisch of diuretisch zijn, mogen niet gelijktijdig met methotrexaat worden toegediend, totdat het belang en de significantie van deze klinische gegevens is vastgesteld.Vitaminepreparaten die foliumzuur of zijn derivaten bevatten, kunnen de respons op methotrexaat veranderen totdat zijn volledige neutralisatie.
Eliminatie van methotrexaat uit de "derde ruimte" (bijv. pleurale effusie of ascites) vindt langzaam plaats, wat resulteert in een verlenging van de terminale plasmahalfwaardetijd en onverwachte toxiciteit. Bij patiënten met een aanzienlijke vochtophoping in de derde ruimte, is het raadzaam om de effusie vóór de behandeling met methotrexaat op te zuigen en de plasmaspiegels te controleren.
Methotrexaat moet met uiterste voorzichtigheid worden gebruikt bij infecties, maagzweren, colitis ulcerosa, verzwakking en bij zeer jonge of zeer oude patiënten. Diarree en ulceratieve stomatitis vereisen stopzetting van de behandeling, anders kunnen hemorragische enteritis en overlijden na darmperforatie optreden.
Als tijdens de behandeling ernstige leukopenie optreedt, kan een bacteriële infectie optreden; in dit geval is het raadzaam om het gebruik van het geneesmiddel te staken en een adequate antibiotische therapie te starten. Bij ernstige onderdrukking van de beenmergactiviteit zijn bloed- of bloedplaatjestransfusies vereist.
Net als andere cytotoxische geneesmiddelen kan methotrexaat een "tumorlysissyndroom" veroorzaken bij patiënten met snelgroeiende tumoren. Passende algemene en farmacologische ondersteunende maatregelen kunnen deze complicatie voorkomen of verlichten.
Onverwacht ernstige (soms fatale) onderdrukking van beenmergactiviteit, aplastische anemie en gastro-intestinale toxiciteit zijn gemeld bij gelijktijdige toediening van methotrexaat (meestal in hoge doses) en NSAID's.
Door methotrexaat geïnduceerde longziekte, waaronder acute of chronische interstitiële interstitiële pneumonie, kan op elk moment tijdens de behandeling optreden; het is gemeld bij lage doses. Het is niet altijd volledig omkeerbaar en er zijn gevallen met fatale afloop gemeld. Bij longsymptomen (vooral een droge, niet-productieve hoest) kan het nodig zijn de behandeling te staken en zorgvuldig te onderzoeken.
Er is gevonden dat methotrexaat een immunosuppressieve werking kan uitoefenen; dit effect moet worden overwogen bij de evaluatie van het gebruik van het geneesmiddel wanneer de immunologische respons bij een patiënt belangrijk of essentieel kan zijn.
Patiënten die met methotrexaat worden behandeld, moeten nauwlettend worden gevolgd. Methotrexaat kan ernstige toxiciteit veroorzaken. In elk geval moet de arts, wanneer Methotrexaat wordt gebruikt bij chemotherapie, de noodzaak en het nut van het preparaat afwegen tegen het risico op toxische effecten of bijwerkingen. De toxische effecten kunnen, in frequentie en ernst, verband houden met de dosis of met de frequentie van toediening, maar toxiciteit is bij alle doses waargenomen en kan op elk moment tijdens de behandeling optreden. De meeste bijwerkingen zijn reversibel als ze vroeg worden gediagnosticeerd. Wanneer dergelijke reacties optreden, moet de dosis worden verlaagd of moet de toediening worden gestaakt. medicatie en een geschikte behandeling nemen (zie Overdosering). Indien nodig kunnen dergelijke behandelingen het gebruik van calciumfolinaat en/of intermitterende hemodialyse met een high-flux dialysator omvatten. Als de behandeling met methotrexaat wordt hervat, moet dit met grote voorzichtigheid gebeuren, waarbij voldoende rekening wordt gehouden met de verdere noodzaak van het medicijn en met meer aandacht voor de mogelijkheid gal herhaling van toxiciteit.
Houd er rekening mee dat tijdens een behandeling met methotrexaat met hoge doses het essentieel is om een diurese van ten minste 2 liter in 24 uur en een urine-pH van niet minder dan 6,5 te verzekeren.
Methotrexaat kan ernstige hematopoëtische weefseldepressie veroorzaken en moet met voorzichtigheid worden gebruikt bij patiënten met een verminderde beenmergfunctie en eerdere of gelijktijdige breedveldradiotherapie. Alle patiënten die een behandeling met methotrexaat ondergaan, moeten zorgvuldig worden gecontroleerd en de volgende symptomen zijn tekenen van toxiciteit: gastro-intestinale ulceratie en bloeding, waaronder stomatitis, beenmergdepressie, die voornamelijk de elementen van de witte reeks aantast, en alopecia. In het algemeen is bij elk individu de toxiciteit direct gerelateerd aan de dosis.
Maligne lymfomen kunnen optreden bij patiënten die een lage dosis methotrexaat krijgen, wat kan afnemen na stopzetting van de behandeling met methotrexaat, en daarom is mogelijk geen cytotoxische behandeling nodig. Stop eerst met Methotrexaat en als het lymfoom niet achteruitgaat, start dan een geschikte behandeling.
Methotrexaat, dat tegelijk met radiotherapie wordt gegeven, kan het risico op necrose van de weke delen en osteonecrose verhogen.
Methotrexaat moet worden toegediend onder persoonlijk en nauwlettend toezicht van de arts, die de patiënt niet in één keer grotere hoeveelheden mag voorschrijven dan de dosering die nodig is voor 6-7 dagen therapie. Er moet wekelijks een volledige bloedtelling worden uitgevoerd. De dosering moet worden stopgezet of de dosering moet worden verlaagd onmiddellijk nadat de eerste tekenen van ulceratie, bloeding, diarree of significante depressie verschijnen.
Methotrexaat heeft, net als de meeste geneesmiddelen tegen kanker en immunosuppressiva, onder bepaalde experimentele omstandigheden kankerverwekkende eigenschappen bij dieren aangetoond. Methotrexaat mag alleen worden gebruikt door artsen die ervaring hebben op het gebied van antimetabolieten.
Patiënten moeten worden geïnformeerd over de mogelijke risico's en voordelen van het gebruik van methotrexaat (inclusief de eerste symptomen en tekenen van toxiciteit), de noodzaak om zo nodig snel hun arts te raadplegen en de noodzaak van een nauwgezette follow-up, inclusief medische tests. toxiciteit De risico's van effecten op de reproductieve prestatie moeten worden besproken met patiënten, zowel vrouwen als mannen, die worden behandeld met methotrexaat.
Toestanden van folaatdeficiëntie kunnen de toxiciteit van methotrexaat verhogen.
verdraagbaarheid
Maagdarmstelsel
Als braken, diarree of stomatitis resulterend in uitdroging optreden, moet methotrexaat worden gestaakt totdat de symptomen zijn verdwenen.
Hematopoëtisch systeem
Methotrexaat kan hematopoëse onderdrukken en bloedarmoede, aplastische anemie, pancytopenie, leukopenie, neutropenie en/of trombocytopenie veroorzaken.Methotrexaat moet met voorzichtigheid worden gebruikt, vooral bij patiënten met kwaadaardige ziekten en reeds bestaande hematopoëtische deficiëntie.methotrexaat mag alleen worden voortgezet als de mogelijke voordelen opwegen tegen het risico op ernstige myelosuppressie.
Leversysteem
Methotrexaat veroorzaakt acute hepatitis en chronische hepatotoxiciteit (fibrose en cerrose) Chronische toxiciteit is potentieel fataal en treedt meestal op na langdurig gebruik (meestal 2 jaar of langer) en na een totale cumulatieve dosis van ten minste 1,5 gram In onderzoeken uitgevoerd bij patiënten met psoriasis , lijkt hepatotoxiciteit een functie te zijn van de totale cumulatieve dosis en lijkt te worden verhoogd door alcoholisme, obesitas, diabetes en ouderdom. Voorbijgaande afwijkingen van leverparameters worden vaak waargenomen na toediening van methotrexaat en vormen meestal geen reden om de behandeling aan te passen. Aanhoudende leverafwijkingen en/of verlagingen van serumalbumine kunnen wijzen op ernstige levertoxiciteit.
Als de resultaten van de leverbiopsie lichte veranderingen laten zien (Roenigk-schaal I, II, IIIa), kan de behandeling met methotrexaat worden voortgezet door de patiënt te volgen volgens de bovenstaande aanbevelingen. De behandeling met methotrexaat moet worden stopgezet bij alle patiënten die aanhoudende afwijkingen in de leverfunctietest vertonen en weigeren een leverbiopsie te ondergaan, en bij alle patiënten bij wie een leverbiopsie matige tot ernstige veranderingen vertoont (Roenigk IIIb-schaal of IV).
Immunologische toestanden
Methotrexaat moet met uiterste voorzichtigheid worden gebruikt bij actieve infecties en is over het algemeen gecontra-indiceerd bij patiënten met manifeste of laboratorium-aangetoonde immunodeficiëntiesyndromen.
Immunisatie
Immunisatie kan ineffectief zijn tijdens behandeling met methotrexaat.Vaccinatie met levende virusvaccins wordt over het algemeen niet aanbevolen. Gevallen van gedissemineerde vaccininfectie na immunisatie met het pokkenvirus zijn gemeld bij patiënten die methotrexaat kregen.
infecties
Er kan longontsteking optreden (wat in sommige gevallen kan leiden tot ademhalingsfalen). Levensbedreigende opportunistische infecties, vooral pneumonie, kunnen optreden bij behandeling met methotrexaat Pneumocystis carinii. Wanneer een patiënt longsymptomen vertoont, moet altijd rekening worden gehouden met de mogelijkheid van Penumocystis carinii-pneumonie.
Zenuwstelsel
Gevallen van leuko-encefalopathie zijn gemeld na intraveneuze toediening van methotrexaat bij patiënten die craniospinale bestraling ondergaan. Ernstige neurotoxiciteit, die zich vaak manifesteert als focale of gegeneraliseerde aanvallen, is gemeld met een onverwacht verhoogde frequentie bij pediatrische patiënten met acute lymfatische leukemie die werden behandeld met intermediaire doses methotrexaat intraveneus toegediend (1 g/m2). Bij symptomatische patiënten werden vaak micro-angiopathische leuko-encefalopathie en/of calcificaties waargenomen in onderzoeken met diagnostische beeldvormingsmethoden. Chronische leuko-encefalopathie is ook gemeld bij patiënten die herhaaldelijk hoge doses methotrexaat hebben gekregen met calciumfolinaat-rescue, zelfs zonder bestraling van de schedel. Er zijn ook gevallen van leuko-encefalopathie geweest bij patiënten die oraal methotrexaat kregen. Stoppen met methotrexaat leidt niet altijd tot volledig herstel.
Een voorbijgaand acuut neurologisch syndroom is waargenomen bij patiënten die werden behandeld met regimes met hoge doses. Manifestaties van dit neurologische syndroom kunnen gedragsafwijkingen, focale sensomotorische tekenen, waaronder voorbijgaande blindheid, en abnormale reflexen omvatten. De exacte oorzaak is niet bekend.
Na intrathecaal gebruik van methotrexaat kan de toxiciteit die kan optreden in het centrale zenuwstelsel als volgt worden ingedeeld: acute chemische arachnoïditis die zich manifesteert met symptomen zoals hoofdpijn, rugpijn, nekstijfheid en koorts; subacute myelopathie die wordt gekenmerkt door bv. paraparese/paraplegie geassocieerd met betrokkenheid van een of meer spinale zenuwwortels; chronische leuko-encefalopathie die zich manifesteert bijv. met verwardheid, prikkelbaarheid, slaperigheid, ataxie, dementie, toevallen en coma centraal zenuwstelsel kan progressief en zelfs fataal zijn Bestraling van de schedel in combinatie met intrathecale toediening van methotrexaat is aangetoond om de incidentie van leuko-encefalopathie te verhogen Tekenen van neurotoxiciteit (meningeale irritatie, permanente of voorbijgaande parese, encefalopathie) moeten worden gecontroleerd na intrathecale toediening van methotrexaat.
Intrathecale en intraveneuze toediening van methotrexaat kan acute encefalitis en acute encefalopathie veroorzaken met fatale afloop.
Er zijn meldingen geweest van patiënten met periventriculair lymfoom van het centrale zenuwstelsel die hersenhernia ontwikkelden bij intrathecale toediening van methotrexaat.
Ademhalingssysteem
Pulmonale tekenen en symptomen, bijvoorbeeld droge niet-productieve hoest, koorts, hoesten, pijn op de borst, dyspneu, hypoxemie en röntgeninfiltraat van de thorax, of niet-specifieke pneumonie die optreedt tijdens de behandeling met methotrexaat, kunnen wijzen op mogelijk schadelijk letsel en stopzetting van de behandeling en zorgvuldige controle Longlaesies kunnen bij elke dosering optreden Infectie (inclusief pneumonie) moet worden uitgesloten.
Longfunctietesten kunnen nuttig zijn als longziekte wordt vermoed, vooral als er baselinegegevens beschikbaar zijn.
urinestelsel
Methotrexaat kan nierbeschadiging veroorzaken, wat kan leiden tot acuut nierfalen. Het wordt aanbevolen om extreme aandacht te besteden aan de nierfunctie, inclusief adequate hydratatie, alkalisering van urine, dosering van methotrexatemie en evaluatie van de nierfunctie.
Huid
Ernstige, soms fatale huidreacties, zoals het Stevens-Johnson-syndroom, toxische epidermale necrolyse (syndroom van Lyell) en erythema multiforme, zijn gemeld na enkelvoudige of meervoudige doses methotrexaat.
Reacties traden op binnen een periode van dagen na orale, intramusculaire, intraveneuze of intrathecale toediening van methotrexaat. Genezing werd gemeld bij stopzetting van de behandeling.
Laboratorium testen
Algemeen
De volgende laboratoriumtests moeten worden uitgevoerd voor een juiste klinische evaluatie van patiënten die een behandeling met methotrexaat ondergaan of ondergaan: volledig bloedbeeld met trombocytentelling, hematocriet, urineonderzoek, nierfunctietest en leverfunctietest. Daarnaast moet er een thoraxfoto worden gemaakt. Het doel van deze tests is om eventuele disfuncties vast te stellen en het is noodzakelijk om deze voor, tijdens en aan het einde van de therapie uit te voeren. Frequentere controle kan ook geïndiceerd zijn aan het begin van de behandeling of wanneer de dosering wordt gewijzigd, of tijdens perioden met een verhoogd risico op hoge bloedspiegels van methotrexaat (bijv. dehydratie).Een volledige bloedtelling moet elke dag worden uitgevoerd gedurende de eerste maand van therapie en daarna 3 keer per week. Het kan nuttig of belangrijk zijn om een leverbiopsie of beenmergbiopsie uit te voeren tijdens langdurige therapie of bij hoge doses.
Longfunctietest
Longfunctietesten kunnen nuttig zijn als longziekte wordt vermoed, vooral als er baselinegegevens beschikbaar zijn
Serumspiegels van methotrexaat
Controle van de serumspiegels van methotrexaat kan de toxiciteit en mortaliteit aanzienlijk verminderen. Patiënten met de volgende aandoeningen zijn vatbaar voor het ontwikkelen van hoge of langdurige methotrexaatspiegels en hebben baat bij periodieke controle van het niveau: pleurale effusie, ascites, occlusie van het maagdarmkanaal, eerdere behandeling met cisplatine, dehydratie, acidurie, verminderde nierfunctie.
Sommige patiënten kunnen een verlengde klaring van methotrexaat hebben zonder deze kenmerken. Het is belangrijk dat patiënten binnen 48 uur worden geïdentificeerd, aangezien de toxiciteit van methotrexaat mogelijk niet omkeerbaar is als de calciumfolinaat-rescue langer dan 42-48 uur wordt uitgesteld.
De methode voor het bewaken van de methotrexaatconcentraties varieert van centrum tot centrum.
Controle van de methotrexaatconcentraties moet de bepaling van de methotrexaatspiegels na 24, 48 of 72 uur omvatten en de beoordeling van de snelheid waarmee de methotrexaatconcentraties afnemen (of het bepalen hoe lang de redding met calciumfolinaat moet worden voortgezet).
Gebruik bij oudere patiënten:
Vanwege een verminderde lever- en nierfunctie en verminderde folaatreserves bij oudere patiënten, moeten lagere doses worden overwogen en deze patiënten moeten nauwlettend worden gecontroleerd op de vroegste tekenen van toxiciteit.
De veiligheid en werkzaamheid bij pediatrische patiënten zijn alleen vastgesteld voor chemotherapie tegen kanker. Er is melding gemaakt van dodelijke toxiciteit als gevolg van fouten in de intraveneuze en intrathecale dosisberekeningen. Er moet speciale aandacht worden besteed aan de dosisberekeningen.
Geneesmiddel dat natrium bevat, is daarom niet geschikt voor personen die een natriumarm dieet moeten volgen.
04.5 Interacties met andere geneesmiddelen en andere vormen van interactie
Salicylverbindingen, sommige sulfonamiden, para-amino-benzoëzuur (PABA), fenylbutazon, difenylhydantoïne, tetracyclines en chlooramfenicol kunnen ervoor zorgen dat methotrexaat niet langer aan plasma-eiwitten bindt.
Methotrexaat bindt gedeeltelijk aan serumalbumine en de toxiciteit kan worden verhoogd door verdringing veroorzaakt door andere sterk bindende geneesmiddelen aan plasma-eiwitten, zoals salicylaten, fenylbutazon, fenytoïne en sulfonamiden.
Aangezien methotrexaat onveranderd wordt uitgescheiden door renale excretie na glomerulaire filtratie, actieve tubulaire secretie en passieve tubulaire reabsorptie, kan elk nefrotoxisch geneesmiddel de renale excretie van methotrexaat verminderen.Daarom is het een goede gewoonte om deze geneesmiddelen tijdens de behandeling met methotrexaat niet toe te dienen. Het transport van methotrexaat door de nieren wordt verminderd door probenecide, het gebruik van methotrexaat met dit geneesmiddel moet zorgvuldig worden gecontroleerd. Fenylbutazon in combinatie met methotrexaat heeft in sommige gevallen toxiciteit veroorzaakt met koorts en huidulcera, beenmergdepressie en overlijden bij bloedvergiftiging. Het mechanisme van deze actie is drievoudig: verdringing van methotrexaat van binding aan plasma-eiwitten, remming van renale tubulaire secretie en beenmergdepressie. Bovendien lijkt fenylbutazon ook nierbeschadiging te veroorzaken, wat kan leiden tot een ophoping van methotrexaat.
Niet-steroïde anti-inflammatoire geneesmiddelen (NSAID's) mogen niet worden gegeven vóór of in combinatie met regimes met hoge doses methotrexaat, zoals die worden gebruikt bij de behandeling van osteosarcoom. Er is gemeld dat gelijktijdige toediening van NSAID's met behandeling met hoge doses Methotrexaat verhoogt en verlengt de serumspiegels van methotrexaat in de loop van de tijd, resulterend in overlijden als gevolg van ernstige hematologische en gastro-intestinale toxiciteit (zie 4.4).
Methotrexaat in combinatie met leflunomide kan het risico op pancytopenie verhogen
Van NSAID's en salicylaten is gemeld dat ze de tubulaire secretie van methotrexaat in een diermodel verminderen en de toxiciteit ervan kunnen versterken door methotrexatemie te verhogen. Daarom is voorzichtigheid geboden bij gelijktijdige toediening van NSAID's of salicylaten met lagere doses methotrexaat (zie 4.4).
Bij de behandeling van patiënten met osteosarcoom is voorzichtigheid geboden bij het toedienen van hoge doses methotrexaat in combinatie met een mogelijk nefrotoxisch chemotherapeutisch middel (bijv. cisplatine). De klaring van methotrexaat wordt verminderd door cisplatine.
Orale antibiotica zoals tetracyclines, chlooramfenicol en breedspectrum-gastro-intestinale (niet-resorbeerbare) antibiotica kunnen de intestinale absorptie van methotrexaat verminderen of de enterohepatische circulatie verstoren door de darmflora te remmen en het metabolisme van het geneesmiddel door bacteriën te onderdrukken.
Penicillines en sulfonamiden kunnen de renale klaring van methotrexaat verminderen; Verhoogde serumconcentraties van methotrexaat met gelijktijdige hematologische en gastro-intestinale toxiciteit zijn waargenomen bij zowel lage als hoge doses. Daarom moet het gebruik van methotrexaat met penicillines nauwlettend worden gecontroleerd.
De mogelijke toename van hepatotoxiciteit gerelateerd aan de gelijktijdige toediening van methotrexaat met andere hepatotoxische middelen is niet onderzocht. In dergelijke gevallen is echter hepatotoxiciteit gemeld. Daarom moeten patiënten die methotrexaat gebruiken en die andere potentieel hepatotoxische geneesmiddelen gebruiken (bijv. leflunomide, azathioprine, retinoïden, sulfasalazine) nauwlettend worden gecontroleerd op een mogelijk verhoogd risico op hepatotoxiciteit.
Methotrexaat kan de theofyllineklaring verminderen; theofyllinespiegels moeten worden gecontroleerd bij gelijktijdige toediening met methotrexaat.
Er is gemeld dat trimethoprim/sulfamethoxazol in zeldzame gevallen heeft geleid tot een verhoogde beenmergsuppressie bij patiënten die met methotrexaat werden behandeld, mogelijk als gevolg van verminderde tubulaire secretie en/of een additief antipholic effect.
Methotrexaat verhoogt de plasmaspiegels van mercaptopurines. De combinatie van methotrexaat en mercaptopurine kan daarom een dosisaanpassing vereisen.
Vitaminepreparaten die foliumzuur of derivaten bevatten, kunnen de respons op systemisch toegediend methotrexaat verminderen, maar folaatdeficiëntie kan de toxiciteit van methotrexaat verhogen. Hoge doses leucovorine kunnen de werkzaamheid van intrathecaal toegediend methotrexaat verminderen.
Methotrexaat, dat tegelijk met radiotherapie wordt gegeven, kan het risico op necrose van de weke delen en osteonecrose verhogen.
04.6 Zwangerschap en borstvoeding
Zie rubrieken 4.3 en 4.4.
04.7 Beïnvloeding van de rijvaardigheid en het vermogen om machines te bedienen
Sommige effecten die in rubriek 4.8 worden genoemd, zoals duizeligheid en vermoeidheid, kunnen de rijvaardigheid of het vermogen om machines te bedienen beïnvloeden.
04.8 Bijwerkingen
De meest voorkomende bijwerkingen zijn: ulceratieve stomatitis, leukopenie, misselijkheid en buikpijn. Andere vaak gemelde bijwerkingen zijn: malaise en overmatige vermoeidheid, koude rillingen en koorts, duizeligheid, verminderde weerstand tegen infecties. De ernst en incidentie van acute bijwerkingen zijn over het algemeen gerelateerd aan de dosering en frequentie van toediening.
Andere mogelijke bijwerkingen worden hieronder vermeld. In een oncologisch beeld maken gelijktijdige behandeling en een reeds bestaande aandoening het moeilijk om een specifieke reactie aan methotrexaat toe te schrijven.
Huid: erythemateuze uitslag, erythema multiforme, toxische epidermale necrolyse (syndroom van Lyell), Stevens-Johnson-syndroom, huidnecrose, exfoliatieve dermatitis, huidulceratie, pruritus, urticaria, fotosensitiviteit, pigmentveranderingen, alopecia, ecchymose, teleangiëctasie, acne, furunculose, optreden van knobbeltjes.
Aandoeningen van het lymfestelsel en bloed: onderdrukking van beenmergactiviteit, onderdrukking van hematopoëse, leukopenie, pancytopenie, neutropenie, trombocytopenie, agranulocytose, eosinofilie, anemie, hypogammaglobulinemie, bloedingen op verschillende plaatsen, septikemie, aplastische anemie, reversibele lymfadenopathie en lymfoproliferatieve aandoeningen (inclusief lymfoproliferatieve aandoeningen).
Metabolisme en voedingsstoornissen: suikerziekte.
Spijsverteringsstelsel: pancreatitis, enteritis, gingivitis, faryngitis, stomatitis, anorexia, misselijkheid, braken, diarree, bloeduitstorting, melaena, maagdarmzweer en bloeding, levertoxiciteit resulterend in acute leveratrofie, necrose, vetdegeneratie, chronische fibrose of cirrose acute hepatitis, reductieserum albuminespiegels, verhoging van leverenzymen, leverfalen.
Urogenitaal systeem: ernstige nefropathie / nierinsufficiëntie, azotemie, cystitis, hematurie, veranderingen in ovogenese of spermatogenese, voorbijgaande oligospermie, menstruatiestoornissen, leukorroe, vaginale afscheiding, dysurie, steriliteit, abortus, foetale misvormingen, verlies van libido, impotentie, onvruchtbaarheid.
Aandoeningen van het zenuwstelsel: hoofdpijn, slaperigheid, wazig zien, spraakstoornissen waaronder dysartrie en afasie, leuko-encefalopathie (na orale toediening), hemiparese, parese en convulsies (alleen na parenterale toediening). Voorbijgaande cognitieve disfunctie, stemmingswisselingen, ongewone hoofdsensaties, episodes van leuko-encefalopathie/encefalopathie (alleen na parenterale toediening) zijn gemeld bij lage doseringsschema's Afasie, hemiparese, parese en convulsies, indien gevonden, houden gewoonlijk verband met bloeding of complicaties van intra -arteriële katheterisatie Convulsies, parese, verhoogde cerebrospinale vloeistofdruk zijn gevonden na intrathecale toediening.
Aandoeningen van het immuunsysteem: anafylactoïde reacties, hypogammaglobulinemie.
Cardio-bloedsomloop: pericarditis, pericardiale effusie, hypotensie en trombo-embolische voorvallen (waaronder arteriële trombose, cerebrale trombose, diepe veneuze trombose, retinale veneuze trombose, tromboflebitis en longembolie), vasculitis.
Infecties en parasitaire aandoeningen: Gevallen van opportunistische infecties, waaronder fatale, zijn gemeld bij patiënten die methotrexaat kregen voor neoplastische en niet-neoplastische ziekten. De meest voorkomende infectie was pneumonie, waaronder Pneumocystis carinii-pneumonie.Andere gemelde infecties zijn onder meer nocardiose, histoplasmose, cryptokokkose, Herpes zoster, Herpes simplex-hepatitis en gedissemineerde herpes simplex, fatale sepsis, cytomegalovirus-infecties waaronder cytomegalovirus-pneumonie.
Psychische stoornissen: stemmingswisselingen, voorbijgaande cognitieve disfunctie.
Oculaire apparaten: conjunctivitis, ernstige veranderingen in het gezichtsvermogen van onbekende etiologie,
tijdelijke blindheid / verlies van gezichtsvermogen, wazig zien.
Goedaardige en kwaadaardige neoplasmata (inclusief cystische vormen en poliepen): lymfomen, waaronder reversibel lymfoom, tumorlysissyndroom (alleen na parenterale toediening).
Zwangerschap, perinatale periode en puerperium: foetale afwijkingen, foetale dood, abortus.
Ademhalingssysteem: longfibrose; interstitiële pneumonie, waaronder sterfgevallen en soms chronische obstructieve longziekte, alveolitis, interstitiële, faryngitis kwamen voor.
Andere bijwerkingen: artralgie / myalgie, metabole veranderingen, diabetes, osteoporose, proteïnurie, tumorlysissyndroom, necrose van weke delen en osteonecrose, celatypie van verschillende weefsels, pijnlijke erosies van psoriatische plaques, stressfracturen. Anafylactoïde reacties en plotselinge sterfgevallen zijn ook gemeld.
04.9 Overdosering
In postmarketingervaring zijn gevallen van overdosering met methotrexaat over het algemeen voorgekomen bij orale en intrathecale toediening, hoewel gevallen van overdosering bij intraveneuze en intramusculaire toediening zijn gemeld.
Symptomen van een intrathecale overdosis methotrexaat zijn meestal neurologisch, waaronder hoofdpijn, misselijkheid en braken, convulsies of toevallen en acute toxische encefalopathie. In sommige gevallen werden geen symptomen gemeld. Er zijn meldingen geweest van sterfgevallen als gevolg van intrathecaal toegediende overdoses. Cerebellaire hernia geassocieerd met verhoogde intracraniale druk en acute toxische encefalopathie zijn in deze gevallen ook gemeld.
Er zijn gevallen van overdosering in de literatuur waarin intraveneuze en intrathecale behandeling van carboxypethidase G2 werd gebruikt om de klaring van methotrexaat te versnellen.
Stop of verlaag de dosis bij het eerste teken van ulceratie of bloeding, diarree of duidelijke depressie van het hematopoëtische systeem.
Calciumfolinaat is geïndiceerd om de toxiciteit te verminderen en de effecten van een onbedoeld toegediende overdosis methotrexaat tegen te gaan. De toediening van calciumfolinaat moet zo snel mogelijk worden gestart. Naarmate het interval tussen de toediening van methotrexaat en het begin van de behandeling met calciumfolinaat toeneemt, neemt de activiteit ervan bij het tegengaan van toxiciteit af.
Calciumfolinaat, een specifiek tegengif van methotrexaat, maakt het mogelijk om de toxische effecten van de antimetaboliet op het hematopoëtische systeem en op de slijmvliezen van het spijsverteringsstelsel te neutraliseren. In zijn rol als tegengif wordt calciumfolinaat in verschillende doseringen gebruikt, afhankelijk van het te verkrijgen klinische effect.In geval van accidentele overdosering wordt calciumfolinaat voor intraveneuze infusie aanbevolen om een competitief effect te verkrijgen (tot 100 mg binnen 12 uur. ); om een metabool biochemisch effect te verkrijgen wordt calciumfolinaat intramusculair aanbevolen (10-12 mg elke 6 uur voor 4 doses) of oraal (15 mg elke 6 uur voor 4 doses).
In geval van accidentele toediening moet calciumfolinaat binnen het eerste uur worden toegediend in doses gelijk aan of hoger dan die van methotrexaat; de toediening van calciumfolinaat in latere tijden is minder effectief. Controle van de serumconcentratie van Methotrexaat is essentieel om de optimale dosis en duur van de behandeling met calciumfolinaat te bepalen.
In het geval van een grote overdosis kan hydratatie en alkalisatie van de urine nodig zijn om precipitatie van methotrexaat en/of zijn metabolieten in de niertubuli te voorkomen. Noch hemodialyse, noch peritoneale dialyse bleken de eliminatie van methotrexaat te verbeteren. Er is echter een effectieve klaring van methotrexaat gemeld bij het gebruik van intermitterende hemodialyse met een high-flux dialysator.
Accidentele intrathecale overdosering kan intensieve systemische ondersteuning, hoge doses calciumfolinaat, alkalische diurese en snelle CSF-drainage en ventriculo-lumbale perfusie vereisen.
05.0 FARMACOLOGISCHE EIGENSCHAPPEN
05.1 Farmacodynamische eigenschappen
Farmacotherapeutische categorie: antineoplastische
ATC-code: L01BA01
Methotrexaat is een competitieve foliumzuurantagonist Het werkingsmechanisme van methotrexaat op moleculair niveau is drievoudig: uitputting van intracellulair folaat door inactivering van dihydrofolicoreductase; directe remming van thymidylatosynthetase; remming van folaatafhankelijke enzymen die betrokken zijn bij purine-neosynthese. Het bindt sterk maar reversibel aan dihydrofolicoreductase, waardoor de enzymatische omzetting van foliumzuur in tetrahydrofoliumzuur wordt geremd.Deze enzymatische stilstand leidt tot een uitputting van de gereduceerde folaten die nodig zijn voor de overdracht van monokoolstofeenheden in veel biochemische reacties waarbij de biosynthese van thymidylzuur betrokken is ( nucleotide specifiek voor DNA) en inosinezuurprecursor van de purines die nodig zijn voor de synthese van zowel DNA als RNA. Remming van de thymidylzuursynthese is echter het belangrijkste mechanisme van cytotoxiciteit van methotrexaat. Daarom verstoort Methotrexaat de DNA-synthese en -reparatie en celreplicatie.
Het werkingsmechanisme van methotrexaat is nauw verbonden met de celcyclus en werkt vooral tijdens de synthese van DNA in de S-fase; in feite zijn die zich snel vermenigvuldigende celweefsels met een hoge groeifractie (cellen in cyclus) het meest gevoelig voor de cytotoxische effecten van methotrexaat.
Actief prolifererende weefsels zoals kankercellen, beenmergcellen, embryonale cellen, mond- en darmslijmvlies en blaascellen zijn over het algemeen gevoeliger voor dit effect dan methotrexaat. Wanneer de celproliferatie in tumorweefsel groter is dan die in de meeste normale weefsels, kan Methotrexaat de tumorgroei belemmeren zonder onomkeerbare schade aan normale weefsels te veroorzaken.
Een hoge dosis methotrexaat, gevolgd door calciumfolinaat-rescue, wordt gebruikt als onderdeel van de behandeling van patiënten met niet-gemetastaseerd osteosarcoom. De oorspronkelijke reden voor een hoge-dosis methotrexaat-therapie was gebaseerd op selectieve redding van calciumfolinaat, van normale weefsels. Meer recent bewijs suggereert dat hoge doses methotrexaat ook resistentie tegen methotrexaat kunnen overwinnen die wordt veroorzaakt door verminderde actieve transportmechanismen, verminderde affiniteit van dihydrofolaatreductase voor methotrexaat, verhoogde niveaus van dihydrofolaatreductase als gevolg van "genamplificatie, of verminderde polyglutamatie van methotrexaat. Het huidige werkingsmechanisme is niet bekend.
Lage doses methotrexaat kunnen S-fase-leukemische myeloblasten gedurende ongeveer 20 uur stoppen, terwijl ze niet actief zijn op G1-, G2- of M-fasecellen Hogere doses methotrexaat (> 30 mg/m2) stoppen S-fase-myeloblasten voor meer dan 48 uur en vertragen de passage van cellen van de G2-fase naar de S-fase.
Methotrexaat remt ook de eiwitsynthese omdat de gereduceerde folaten fungeren als co-factoren voor de onderlinge omzetting van de aminozuren glycine in serine en homocysteïne in methionine. Dit kan het mechanisme zijn dat de werking van hoge doses methotrexaat bij het stoppen van G1-fasecellen verklaart. Folicoreductase is een secundair doelwit wanneer de concentratie van intracellulair methotrexaat hoog is; in feite worden in deze specifieke omstandigheden thymidylatosynthetase en purine-neosynthese primaire doelen en het is deze chemische laesie die verantwoordelijk is voor onmiddellijke cytolyse.
In feite vertegenwoordigt folicoreductase een "receptor met hoge affiniteit" voor methotrexaat, terwijl de enzymen die betrokken zijn bij de biosynthese van purine en thymidylatosynthetase zich gedragen als "receptoren met lage affiniteit".
05.2 Farmacokinetische eigenschappen
Na toediening van hoge doses Methotrexaat van 50 tot 200 mg/kg, worden gemiddelde plasmapieken bereikt die variëren tussen 0,14 mM en 1 mM tijdens de 6-uurs infusie, volgens een dosisafhankelijke trend. "gebruik van conventionele doseringen, heeft een trend in drie fasen met een halfwaardetijd in de eerste fase van ongeveer 45", overeenkomend met de distributiefase; de "halfwaardetijd van de tweede fase is variabel tussen 2 en 3 uur en komt overeen tot de renale klaring; de halfwaardetijd van de laatste fase is 8-12 uur; de verlenging van deze fase vertegenwoordigt een gecombineerd effect van afgifte uit celcompartimenten, uit de entero-hepatische circulatie en reabsorptie uit de niertubuli. Na intrathecale, intramusculaire of intraperitoneale toediening, de bloedpiek treedt op in 15-30 ". Wanneer het geneesmiddel intrathecaal wordt toegediend, verlaat het de cerebrospinale vloeistof vrij langzaam en worden de plasmaspiegels 2 tot 3 keer langer gehandhaafd dan na IV toediening. Daarom kan intrathecale toediening leiden tot grotere toxiciteit dan parenterale toediening.
Bij doses van 30 mg/m2 of lager wordt Methotrexaat over het algemeen goed geabsorbeerd met een gemiddelde biologische beschikbaarheid van ongeveer 60%. De absorptie van doses boven 80 mg/m2 is beduidend minder, waarschijnlijk door een verzadigingseffect.
Plasma-eiwitbinding:
Van 50% tot 70% van het toegediende methotrexaat bindt zich reversibel aan plasma-eiwitten, voornamelijk albumine. In interstitiële vloeistoffen daarentegen is de binding aan eiwitten laag, variërend van 0 tot 17%. De veranderingen van het serum-eiwitbeeld invloed op de hoeveelheid vrij (extracellulair) Methotrexaat en daarmee op de intracellulaire penetratie alsook op de renale klaring Veel geneesmiddelen zoals salicylaten, sulfonamiden, PABA, fenylbutazon, enz. strijden om deze schakel.
Volumes van schijnbare distributie, weefseldiffusie:
Na intraveneuze toediening wordt Methotrexaat snel gedistribueerd in een volume gelijk aan 18% van het lichaamsgewicht, overeenkomend met de extracellulaire ruimte en dus in een volume gelijk aan 76% van het lichaamsgewicht, overeenkomend met het totale watergehalte van het organisme. met een lever/plasmaverhouding van 4 na 3 uur en 8 na 24 uur iv toediening van 80mg/m2. Het medicijn wordt geconcentreerd in de galblaas tot > 1000 keer het plasmaniveau, uitgescheiden met de gal en uiteindelijk gedeeltelijk opnieuw geabsorbeerd door het darmslijmvlies. De diffusie van methotrexaat in de subarachnoïdale ruimten, in de pleurale en peritoneale holte gebeurt langzaam en met kenmerken die vergelijkbaar zijn met passief transport. Als deze "derde ruimtes" pathologisch verwijd zijn, zoals in het geval van ascites of pleurale effusie, kunnen ze als reserve fungeren en de persistentie van methotrexaat in het plasmacompartiment verlengen. De concentratieverhoudingen van Methotrexaat in plasma met betrekking tot: melk, tranen, vloeistof en speeksel zijn respectievelijk 20/1, 33/1, 300/1. De weefsels waar Methotrexaat bij voorkeur wordt gelokaliseerd zijn: de proximale tubulus van het nefron, het darmepitheel en hepatocyten Het penetratiemechanisme van Methotrexaat in normale en neoplastische cellen is actief, gemedieerd door membraandrager en dus met energieverbruik Methotrexaat concurreert met verminderde folaat voor actief transport door het celmembraan door een proces dat wordt gemedieerd door een enkele actieve transporter. Bij serumconcentraties van meer dan 100 micromolair wordt passieve diffusie de primaire route waardoor ze effectieve intracellulaire concentraties kunnen bereiken. De opname van het geneesmiddel door myeloblasten in gezonde proefpersonen en leukemie treedt met een zekere traagheid op en duurt 1 tot 4 uur voordat een evenwicht is bereikt In tumorweefsels worden hogere concentraties methotrexaat bereikt dan in gezonde weefsels.
Kinetiek van de passage van de bloed-hersenbarrière:
De bloed-hersenbarrière voorkomt dat systemisch toegediend Methotrexaat het CZS binnendringt Therapeutisch gedoseerd Methotrexaat dringt niet door de bloed-hersenbarrière bij orale of parenterale toediening Hoge concentraties methotrexaat in de cerebrospinale vloeistof kunnen worden verkregen door intrathecale toediening De verhouding van CSF tot plasma concentraties is 0,02 - 0,05. Bij hoge doses, 50 mg / kg Methotrexaat, bereikt de CSF-concentratie 7 x 10-6 M / L (na 6 uur infusie), terwijl voor doses gelijk aan 100 mg / kg 3 x 10 -6M / l. Na intrathecale toediening van methotrexaat verlaat het geneesmiddel langzaam dit compartiment om in de circulatie te komen volgens een bimodale kinetiek: de twee halfwaardetijden a en b zijn respectievelijk 1,7 en 6,6 uur De tweede halfwaardetijd b is verlengd tot 7,3 uur bij gelijktijdige toediening van acetazolamide, tot 7,7 uur bij toediening van probenec id (2500 mg) of om 7,9 uur in aanwezigheid van intracraniële hypertensie.
Weg en kinetiek van eliminatie:
Methotrexaat wordt uitgescheiden in de urine, feces en gal; klaring van methotrexaat uit plasma is ongeveer 110 mg/min/m2, waarvan meer dan 90% te wijten is aan nierfunctiestoornis (wanneer de nierfunctie intact is) Ongeveer 43% van de toegediende dosis verschijnt in het eerste uur in de urine Bijna de helft van een intraveneuze toegediende dosis wordt binnen 6 uur na toediening onveranderd in de urine uitgescheiden; dit percentage stijgt tot 90% binnen 24 uur en 95% binnen 30 uur. De renale eliminatie van het geneesmiddel en door glomerulaire filtratie vindt voornamelijk plaats door actieve tubulaire secretie . Minder dan 2% van een dosis per i.v. het wordt uitgescheiden in de feces. Vertraagde klaring van het geneesmiddel kan optreden in aanwezigheid van "reserves van de derde ruimte", zoals in het geval van grote pleurale of peritoneale effusies.
Uitscheiding via de nieren is de belangrijkste eliminatieroute en is afhankelijk van de dosis en de toedieningsweg Bij intraveneuze toediening wordt 80-90% van de toegediende dosis binnen 24 uur onveranderd in de urine uitgescheiden. Er is een beperkte uitscheiding via de gal, die ongeveer 10% of minder van de toegediende dosis bedraagt. Een enterohepatische circulatie van methotrexaat is verondersteld.
Uitscheiding via de nieren vindt plaats door glomerulaire filtratie en actieve tubulaire secretie Een verminderde nierfunctie, evenals gelijktijdig gebruik van geneesmiddelen zoals zwakke organische zuren die ook tubulaire secretie ondergaan, kunnen de serumspiegels van methotrexaat aanzienlijk verhogen. Een uitstekende correlatie tussen de klaring van methotrexaat en endogene creatinineklaring is gemeld. De klaringssnelheden van methotrexaat lopen sterk uiteen en nemen over het algemeen af bij hoge doses. Vertraagde geneesmiddelklaring is geïdentificeerd als een van de belangrijkste factoren die verantwoordelijk zijn voor de toxiciteit van methotrexaat. De hypothese is dat de toxiciteit van methotrexaat voor normale weefsels meer afhangt van de duur van de blootstelling aan het geneesmiddel dan van de maximaal bereikte niveaus.Wanneer een patiënt een vertraagde eliminatie van het geneesmiddel vertoont als gevolg van een verminderde nierfunctie, kan een verspreiding naar de derde space of andere oorzaken, kunnen de serumconcentraties van methotrexaat gedurende langere tijd verhoogd blijven.
De potentiële toxiciteit van hoge doseringsschema's of vertraagde excretie wordt verminderd door de toediening van calciumfolinaat tijdens de laatste fase van eliminatie van methotrexaat uit plasma.
Metabolisme:
Na absorptie wordt methotrexaat door intracellulair en levermetabolisme omgezet in polyglutamaatvormen die vervolgens door hydrolase weer kunnen worden omgezet in methotrexaat. Deze polyglutamaten werken als remmers van dihydrofolaatreductase en thymidylaatsynthetase. Kleine hoeveelheden polyglutamaat Methotrexaat kunnen gedurende een langere periode in de weefsels achterblijven. De retentie en langdurige farmacologische werking van deze actieve metabolieten variëren voor verschillende celtypes, weefsels en tumoren. Bij algemeen voorgeschreven doses kan een kleine hoeveelheid omzetting naar 7-hydroxymethotrexaat optreden. Accumulatie van deze metaboliet kan significant worden bij de hoge doses die worden gebruikt voor osteogeen sarcoom.De oplosbaarheid in water van 7-hydroxymethotrexaat is 3-5 keer lager dan methotrexaat.
Ongeveer 6% van een toegediende dosis i.v. en 35% van een oraal toegediende dosis wordt gemetaboliseerd tot 7-hydroxy-methotrexaat in de enterohepatische circulatie, door de werking van een aldehydeoxidase, en tot 2,4-diamino-N10-methylpteroïnezuur (DAMPA) door de werking van de bacteriële darmflora . Deze metabolieten werden geïsoleerd en geïdentificeerd in het plasma en de urine van patiënten, terwijl polyglutamaatderivaten van methotrexaat in de lever werden gevonden. 7-hydroxy-methotrexaat zou verantwoordelijk zijn voor de nefrotoxiciteit van het geneesmiddel dat in hoge doses wordt gebruikt vanwege de slechte oplosbaarheid in water.
Halfwaardetijd: De gerapporteerde terminale halfwaardetijd van methotrexaat is ongeveer 3-10 uur voor patiënten die worden behandeld met reumatoïde artritis of een lage dosis kankertherapie (minder dan 30 mg/m2). Voor patiënten die hoge doses methotrexaat krijgen, is de terminale halfwaardetijd 8 - 15 uur.
05.3 Gegevens uit het preklinisch veiligheidsonderzoek
De LD50 bij muizen was 94 ± 9 mg/kg voor i.p.-toediening; het resulteerde in plaats daarvan gelijk aan 180 ± 45 mg / kg bij orale toediening. Bij ratten was de LD50 variabel tussen 6 en 25 mg/kg voor i.p.
Wanneer Methotrexaat wordt toegediend aan ratten van dag 14 tot dag 18 van de zwangerschap, kan het leiden tot: gewichtsverlies van de moeder, resorptie, abortus of hypotrofie van de foetus. Het medicijn kan zwangerschapsafbreking veroorzaken bij verschillende diersoorten, zoals: muizen, ratten, konijnen Anorexia, waterige diarree en vaginale bloedingen zijn soms waargenomen bij dieren die het medicijn kregen in herhaalde doses van meer dan 0,5 mg/kg, terwijl bij enkelvoudige doses van Bij 1,6 mg/kg werden dergelijke effecten niet gevonden.Methotrexaat heeft, zoals de meeste antikanker- en immunosuppressiva, bij dieren kankerverwekkende eigenschappen laten zien onder bepaalde experimentele omstandigheden.
06.0 FARMACEUTISCHE INFORMATIE
06.1 Hulpstoffen
METHOTREXAAT 50 mg poeder voor oplossing voor injectie:
Natriumchloride, Natriumhydroxide. Bevat geen bewaarmiddelen.
METHOTREXAAT 500 mg poeder voor oplossing voor injectie:
Natriumhydroxide. Bevat geen bewaarmiddelen.
METHOTREXAAT 1 g poeder voor oplossing voor injectie:
Natriumhydroxide. Bevat geen bewaarmiddelen.
METHOTREXAAT 50 mg / 2 ml oplossing voor injectie:
Natriumhydroxide, natriumchloride, water voor injecties.
Bevat geen bewaarmiddelen.
METHOTREXAAT 500 mg / 20 ml oplossing voor injectie:
Natriumhydroxide, natriumchloride, water voor injecties.
Bevat geen bewaarmiddelen.
METHOTREXAAT 1g/10ml oplossing voor injectie:
Natriumhydroxide, water voor injecties.
Bevat geen bewaarmiddelen.
METHOTREXAAT 5 g / 50 m1 oplossing voor injectie:
Natriumhydroxide, water voor injecties.
Bevat geen bewaarmiddelen.
06.2 Incompatibiliteit
Methotrexaat is compatibel met: dextrose in Ringer's lactaat, dextrose in Ringer's, dextrose in natriumchloride, dextrose in water, Ringer's lactaat, natriumchloride.
Methotrexaat mag niet samen met andere geneesmiddelen in hetzelfde infuus worden toegediend.
06.3 Geldigheidsduur
Poeder voor oplossing voor injectie: 3 jaar.
Oplossing voor injectie: 2 jaar.
De vervaldatum verwijst naar het product in intacte verpakking, correct bewaard.
06.4 Speciale voorzorgsmaatregelen bij bewaren
Methotrexaat poeder voor oplossing voor injectie: bewaren bij een temperatuur van maximaal 25 ° C.
Beschermen tegen licht en vocht.
Het product moet onmiddellijk na reconstitutie worden gebruikt; alle ongebruikte oplossing moet worden weggegooid.
Methotrexaatoplossing voor injectie: bewaren bij een temperatuur tussen 15°C-22°C. Bescherm tegen licht.
Het product kan na de eerste herroeping niet opnieuw worden gebruikt; alle ongebruikte oplossing moet worden weggegooid.
06.5 Aard van de primaire verpakking en inhoud van de verpakking
Methotrexaat poeder voor oplossing voor injectie:
Type I of III glazen fles - Rubberen stop voor lyofilisaat met aluminium afdichting.
- flesje van 50 mg
- fles van 500 mg
- 1 g fles
Methotrexaat oplossing voor injectie:
Type I glazen fles
Rubberen kap met aluminium afdichting.
- flesje van 50 mg / 2 ml
- fles van 500 mg / 20 ml
- 1 g / 10 ml fles
- flesje van 5 g / 50 ml
06.6 Instructies voor gebruik en verwerking
Gebruik elke fles slechts één keer.
Als zich een neerslag vormt, moet de oplossing worden weggegooid.
Dien Methotrexaat niet toe met andere geneesmiddelen in hetzelfde infuus.
Mensen die in aanraking komen met kankermedicijnen of werken in gebieden waar deze medicijnen worden gebruikt, kunnen aan deze middelen worden blootgesteld, hetzij door contact met de lucht, hetzij door direct contact met besmette voorwerpen. Potentiële gezondheidseffecten kunnen worden verminderd door zich te houden aan institutionele procedures, gepubliceerde richtlijnen en lokale regelgeving met betrekking tot de bereiding, toediening, transport en verwijdering van gevaarlijke medicijnen. Er is geen algemene overeenstemming dat alle procedures die in de richtlijnen worden aanbevolen, noodzakelijk en passend zijn
Methotrexaat poeder voor oplossing voor injectie:
Methotrexaat 500 mg en Methotrexaat 1 g poeder voor oplossing voor injectie dienen onmiddellijk voor gebruik te worden gereconstitueerd met respectievelijk 10 ml en 20 ml water voor injectie of 5% fysiologische zout- of dextrose-oplossing die geen conserveermiddelen bevat. tot 50 mg/ml, reconstitueer de fles met 1 g methotrexaat met 19,4 ml vloeistof.
Methotrexaat 50 mg poeder voor oplossing voor injectie moet onmiddellijk voor gebruik worden gereconstitueerd met water voor injectie met 20 ml water.
Wanneer hoge doses methotrexaat worden toegediend via intraveneuze infusie, verdun dan de totale dosis in 5% dextrose-oplossing.
Voor intrathecale toediening, reconstitueer tot een concentratie van 1 mg/ml met behulp van een geschikte steriele oplossing, vrij van bewaarmiddelen, zoals zoutoplossing.
Methotrexaatoplossing voor injectie
Indien nodig kan de oplossing, direct voor gebruik, verder worden verdund met fysiologische zoutoplossing of 5% dextrose-oplossing, die geen conserveermiddelen bevat.
07.0 HOUDER VAN DE VERGUNNING VOOR HET IN DE HANDEL BRENGEN
WYETH LEDERLES.p.A.
Via Nettunense, 90
04011 Aprilia (LT)
08.0 NUMMER VAN DE VERGUNNING VOOR HET IN DE HANDEL BRENGEN
Methotrexaat 50 mg poeder voor oplossing voor injectie - A.I.C. nr. 019888041
Methotrexaat 500 mg poeder voor oplossing voor injectie - A.I.C. nr. 019888054
Methotrexaat 1 g poeder voor oplossing voor injectie - A.I.C. nr. 019888104
Methotrexaat 50 mg / 2 ml oplossing voor injectie - A.I.C. nr. 019888080
Methotrexaat 500 mg / 20 ml oplossing voor injectie - A.I.C. nr. 019888092
Methotrexaat 1 g/10 ml oplossing voor injectie - A.I.C. nr. 019888066
Methotrexaat 5 g / 50 ml oplossing voor injectie - A.I.C. nr. 019888078
09.0 DATUM VAN EERSTE VERGUNNING OF VERLENGING VAN DE VERGUNNING
Methotrexaat 50 mg poeder voor oplossing voor injectie - september 1963 / juni 2005
Methotrexaat 500 mg poeder voor oplossing. injecteerbaar: september 1984 / juni 2005
Methotrexaat 1 g poeder voor oplossing voor injectie: april 2000 / juni 2005
Methotrexaat 50 mg / 2 ml oplossing voor injectie: april 2000 / juni 2005
Methotrexaat 500 mg / 20 ml oplossing voor injectie: april 2000 / juni 2005
Methotrexaat 1 g/10 ml oplossing voor injectie: april 2000 / juni 2005
Methotrexaat 5 g / 50 ml oplossing voor injectie: april 2000 / juni 2005
10.0 DATUM VAN HERZIENING VAN DE TEKST
maart 2009